iPS細胞から様々な眼の細胞を選択的に誘導することに成功
大阪大学とロート製薬の再生医療における共同研究
研究成果のポイント
・基底膜タンパク質ラミニンの種類を使い分けることで、iPS細胞から異なる眼の細胞(神経堤細胞、角膜上皮細胞、網膜・角膜を含む多層構造)へ選択的に分化誘導することに成功した。
・iPS角膜上皮シートのもととなるSEAMの発生には、YAPが関与していることが示唆された。
・iPS角膜上皮細胞の作製効率化といった眼の疾患に対するiPS細胞を用いた再生医療の実現が期待される。
概要
大阪大学大学院医学系研究科の林竜平寄附講座教授(幹細胞応用医学寄附講座)、西田幸二教授(眼科学)、柴田峻共同研究員(ロート製薬、眼科学)らの研究グループは、同蛋白質研究所の関口清俊寄附研究部門教授らと共同で、培養皿のコーティングに用いる基底膜タンパク質ラミニン の種類(アイソフォーム)が多能性幹細胞(iPS細胞)の眼の細胞への分化過程における運命決定に寄与していることを明らかにしました。具体的には、ラミニン211、332、511は、iPS細胞を、それぞれ、神経堤細胞、角膜上皮細胞、網膜・角膜等を含む多層構造へ誘導しました。さらに、ラミニン511を用いたiPS細胞の培養によりiPS角膜上皮シートのもととなるSEAM(シーム)が形成されますが、その形成過程にYAP が関与していることが示唆されました。本成果により、iPS細胞の足場による運命決定制御機構や眼の発生機序の解明、さらには角膜再生医療実用化に向けたiPS角膜上皮細胞の作製効率化が期待されます。
本研究成果は、米国科学雑誌「CellReports」に11月6日に掲載されました。

図1 本研究の概念図。
ラミニンのアイソフォームである211,332,511はiPS細胞を、それぞれ神経堤細胞、角膜上皮細胞、網膜・角膜等を含む多層構造へ誘導する。この過程における①iPS細胞との接着、②iPS細胞のコロニー形成、③シグナル、④分化指向性について、それぞれのラミニンのアイソフォームを基質とした際に観察される特徴を示した。
研究の背景
iPS細胞は、無限に増殖し、私たちの身体を構成する様々な細胞に分化することができることから再生医療や創薬研究、発生研究に非常に有用な細胞です。林竜平寄附講座教授、西田幸二教授らのグループは、これまでに、ヒトiPS細胞から眼全体の発生を模倣した2次元培養系を用いて、様々な眼の細胞を含む多層状コロニー(SEAM)を誘導し、さらに、機能的な角膜上皮組織(iPS角膜上皮シート)を作製することに成功しています(Nature 2016) 1) 。iPS角膜上皮シート移植は、外傷や病気により、角膜上皮の幹細胞が失われた難治性角膜疾患に対する新たな再生医療として期待されています。
iPS細胞がどのような細胞になるかという運命決定において、成長因子などを含む培養液と同様に、細胞の足場となる基質も重要な役割を果たすことが近年報告されています。眼全体の発生を模倣したSEAMは、神経、神経提、網膜、角膜等で構成されており、細胞の足場となる基質、基底膜タンパク質“ラミニン”上で、iPS細胞から自律的に発生します。しかしながら、SEAMの発生におけるラミニンの役割はわかっていませんでした。
本研究の成果
研究グループはまず、足場がiPS細胞の分化に与える影響について着目しました。ラミニン211を基質としてiPS細胞を培養し、分化させると、神経堤細胞が多く誘導されました (図2A) 。この際に、Wntシグナルパスウェイに関連する遺伝子やWntシグナルの標的となる遺伝子(AXIN2,LEF1)の発現が上昇しており (図2B) 、神経堤細胞の分化過程においてWntシグナルが活性化していること明らかになりました。次に、ラミニン332を基質としてiPS細胞を培養し、分化を促すと、角膜上皮細胞が多く誘導されました (図3A) 。ラミニン332上で誘導し作製したiPS角膜上皮細胞シートでは、角膜上皮細胞のマーカー(PAX6,KRT12,MUC16,p63)が発現していることが確認されました (図3B) 。また、ラミニン511を基質としてiPS細胞を培養し、分化を促すと、iPS細胞が網膜・角膜を含む多層構造へ分化することが先行研究で明らかとなっていることから、培養皿のコーティングに用いるラミニンのアイソフォームがiPS細胞の眼の細胞への運命決定に寄与していることを新たに明らかにしました。
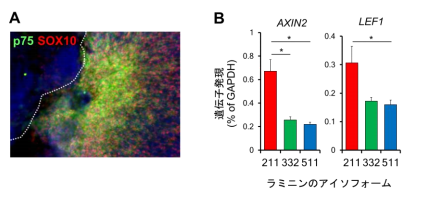
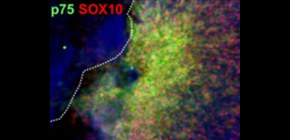
図2 ラミニン211によるWntシグナルを介した神経堤細胞誘導。
(A)ラミニン211を基質としてiPS細胞を培養すると、神経堤細胞へ分化する。p75、SOX10は神経堤細胞へ分化したことを示すマーカー。
(B)iPS細胞を培養する過程で、ラミニン211を基質とした際に、Wntシグナルの標的遺伝子であるAXIN2とLEF1が高発現した。

図3 ラミニン332によるiPS角膜上皮の分化誘導の促進。
(A)ラミニンのアイソフォームによるiPS角膜上皮細胞が誘導される割合を示している。オレンジと白のバーは、異なるiPS細胞株を示す。
(B)ラミニン332で誘導し作成したiPS角膜上皮細胞シートにおいて、角膜上皮細胞のマーカー(PAX6、KRT12、MUC16、p63)が発現していることを示している。
ラミニン511を用いて培養すると、iPS細胞は高度に凝集し (図4A) 、コロニー内の細胞におけるYAPの局在を観察すると、凝集している中央部ではYAPは細胞質に局在していました (図4B) 。つまり、中央部では高い細胞密度によってYAPシグナルがOFFになることが示されました。この中央部では、神経外胚葉マーカーであるN-カドヘリン陽性細胞が分化しました。一方、コロニーの周縁部では、YAPは核に局在し、YAPのシグナルがONになっていました (図4B) 。この周縁部では表面外胚葉のマーカーであるE-カドヘリン陽性細胞が分化しました。以上の結果から、ラミニン511を用いたiPS細胞のSEAMへの分化には、細胞密度によって制御されるYAPシグナルが関連していることが示唆されました。
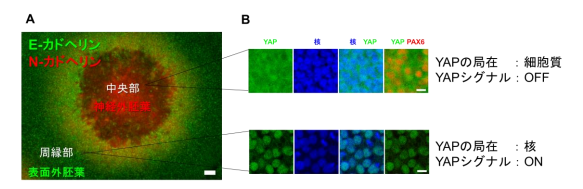
図4 ラミニン511上での多層構造形成の機序。
(A、B)ラミニン511はiPS細胞のコロニーを高度に凝集させ、その細胞密度によってコロニー中央部における細胞のYAPシグナルがOFFになることがわかった。そのために、中央部では神経外胚葉由来の神経や網膜が分化し、コロニー周縁部では表面外胚葉由来の上皮細胞が分化する。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、発生期において、目的の眼組織で発現しているラミニンのアイソフォームを、iPS細胞からの眼細胞分化誘導に用いることで、その組織の誘導を促進する可能性が示唆されました。目的細胞の分化誘導における足場の最適化に役立つ知見となります。また、SEAMの形成におけるYAPの関連が示唆されました。本研究を応用することで、iPS細胞の足場による運命決定制御や眼の発生機序の解明、角膜再生医療実用化に向けたiPS角膜上皮細胞の作製効率化が期待されます。
特記事項
大阪大学とロート製薬は幹細胞技術(培養法・分化誘導法・細胞単離法・評価技術など)とその応用による再生治療法の開発を目指し、2014年に大阪大学大学院医学系研究科附属最先端医療イノベーションセンターに幹細胞応用医学寄附講座を設立し、間葉系幹細胞やiPS細胞を用いた、眼や全身疾患に対する再生医療の開発・実用化を目指した共同研究を行っています。
本研究成果は、米国科学雑誌『Cell Reports』(オンライン、11月6日付け:日本時間11月7日)に掲載されました。
タイトル:“Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct OcularLineages”
著者名:Shun Shibata, Ryuhei Hayashi, Toru Okubo, Yuji Kudo, Tomohiko Katayama, Yuki Ishikawa, Junko Toga,Emiko Yagi, Yoichi Honma, Andrew J. Quantock, Kiyotoshi Sekiguchi, and Kohji Nishida
Cell Reports 2018, Nov 6, 25, 1668–1679.
なお、本研究は、日本医療機構(再生医療実現拠点ネットワークプログラム 再生医療の実現化ハイウェイ)と日本学術振興会(科研費)の助成を受けて行われました。
参考文献
参考URL
大阪大学 大学院医学系研究科 幹細胞応用医学
http://www.med.osaka-u.ac.jp/introduction/research/endowed/stem
用語説明
- ラミニン
上皮組織の基底膜に存在する細胞外マトリックスタンパク質。上皮細胞のインテグリンと結合するため、細胞の足場となります。近年、iPS細胞などの培養基剤として広く用いられております。本研究では、大阪大学蛋白質研究所関口清俊寄附研究部門教授らのグループにより作製されたE8断片と呼ばれるインテグリン結合部位をもつ特殊な組換えラミニンアイソフォームを用いました。
- YAP
転写共役因子として働くタンパク質。Hippoシグナルの主要な制御因子であり、組織の成長と器官の大きさ等を制御します。その他、多能性の維持やメカノセンサーとしての役割も報告されています。
