基底膜と上皮細胞を接着するタンパク質の立体構造を解明
効率的・安価な多能性幹細胞の培養で再生医療分野へ貢献
研究成果のポイント
概要
大阪大学蛋白質研究所の有森貴夫准教授、高木淳一教授らは、同研究所の関口清俊寄附研究部門教授のグループと共同で、インテグリンによるラミニンの認識機構を詳細に明らかにしました。
ラミニンは基底膜の主要な構成分子の一つであり、細胞表面の受容体であるインテグリンに結合することで、上皮細胞を基底膜に接着させ、細胞内に情報を伝えます(図1)。この両分子の結合は、胚発生、臓器の形成や恒常性維持などに関わる非常に重要な分子間相互作用です。しかし、これまでラミニン受容体インテグリンの立体構造は全く報告されておらず、インテグリンによるラミニンの認識機構は詳しくは分かっていませんでした。
今回、有森准教授は、同氏が以前開発したFv-claspという抗体の応用技術を利用することで、代表的なラミニン受容体インテグリンであるヒト由来インテグリンα6β1の結晶構造を世界で初めて決定しました。さらに、このFv-claspの技術をクライオ電子顕微鏡にも応用することで、インテグリンα6β1と、リガンドであるラミニン511の複合体の立体構造の決定にも成功しました。これらの構造から、インテグリンがどのようにラミニンを引き寄せ、特異的に認識し、さらにはその結合によりインテグリンがどのように形を変化させて細胞内へと情報を伝達するのかが明らかになりました。この両分子の相互作用は、多能性幹細胞の培養時においても重要な働きをしており、これらの情報は、再生医療分野にも貢献することが期待されます。
本研究成果は、米国科学誌「Nature Communications」に、6月29日(火)18時(日本時間)に公開されました。
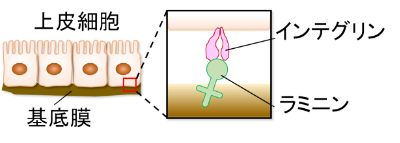
図1. 上皮細胞の基底膜への接着
研究の背景
生体内の様々な臓器の表面は、基底膜というシート状の構造体の上に接着した上皮細胞により構成されています。各臓器が正常に機能する上で、基底膜への細胞接着とそれに伴う情報伝達は必須のプロセスであり、ここで働く分子の相互作用は、多細胞生物を構成・維持する上で最も基本となる相互作用の一つと言えます。この細胞接着において中心的な役割を果たしているのが、基底膜の主要な構成分子であるラミニンと、その受容体であるインテグリンです。ラミニンはα、β、γという3つの鎖から構成される非常に巨大な分子ですが、これまでに高木教授のグループと関口教授のグループは共同で、ヒト由来ラミニン511(α5、β1、γ1により構成)のインテグリン結合断片の創製に成功し、さらにその結晶構造を決定して2017年に報告しています(https://resou.osaka-u.ac.jp/ja/research/2017/20170902_1)。一方、インテグリンはαとβという2つの鎖から構成される膜上の分子で、細胞と細胞外マトリックス蛋白質の接着や細胞同士の接着に関わる受容体ファミリーです。ヒトでは、α鎖とβ鎖の組み合わせが異なる24種類のインテグリン分子の存在が知られており、そのうち4種がラミニン受容体として分類されています。中でもインテグリンα6β1は、ラミニン511に対して高い親和性を持つ代表的なラミニン受容体です。インテグリンは、リガンドの結合に伴い大きく構造を変化させることで細胞外の情報を細胞内に伝達すると考えられていますが、そのような構造の柔軟性のため構造解析が非常に困難な分子であり、ラミニン受容体インテグリンについてはこれまで全く立体構造が明らかになっていませんでした。
研究の成果
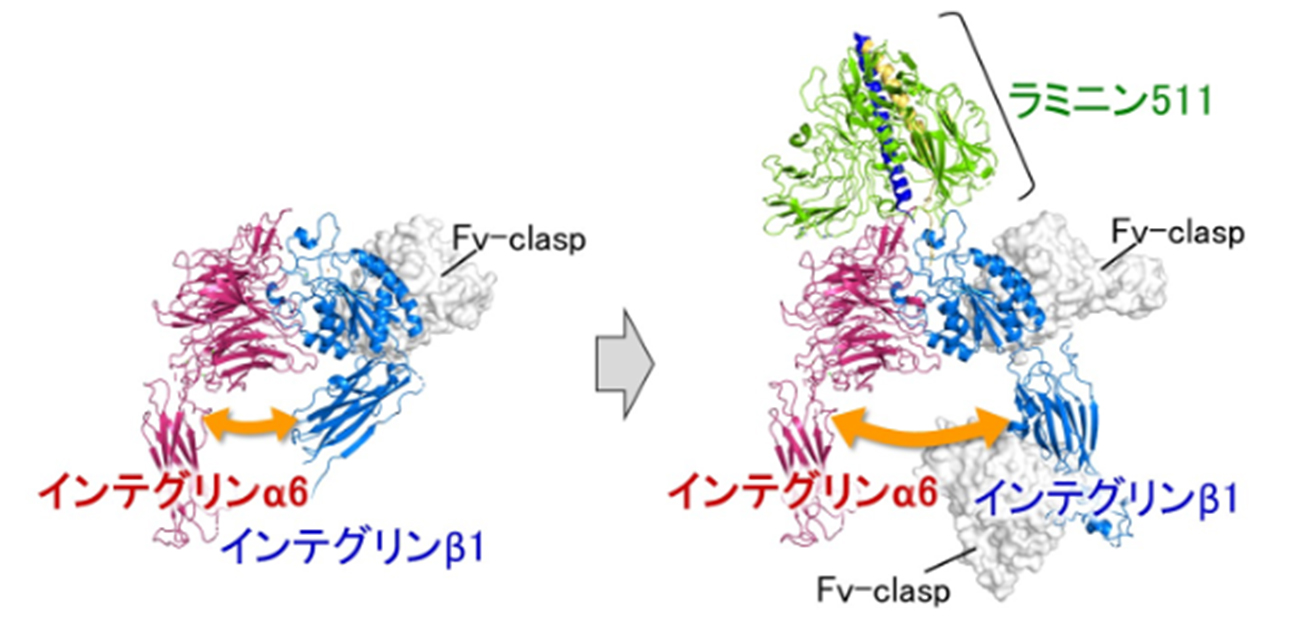
有森准教授は、インテグリンα6β1の構造解析を成功させるため、Fv-claspという小型抗体の技術を応用しました。構造解析が難しい分子では、それを助けるためのツールとして、抗体を断片化した小型抗体がしばしば応用されています。その理由の一つとして、抗体が結合すると標的タンパク質の構造が安定化する(固定される)ことが挙げられます。構造が均一であることは、X線結晶構造解析においてもクライオ電子顕微鏡においても重要な要素になります。Fv-claspは、同氏らが開発した新しい小型抗体のフォーマットで、構造解析に従来よく用いられているFabや一本鎖抗体(scFv)といった小型抗体と比べて、生産性や安定性が高いだけでなく、構造の剛性が高いために構造解析への応用に非常に適していることが知られています。インテグリンα6β1の結晶化においては、Fabを利用しても結晶が得られませんでしたが、Fv-claspを用いることで初めて結晶の取得と構造決定に成功しました(図2、左)。さらに、インテグリンα6β1とラミニン511の複合体においては、2種類のFv-claspを結合させることでより構造が安定化し、クライオ電子顕微鏡による構造決定が可能になりました(図2、右)。
得られた立体構造から、ラミニンの結合に伴いインテグリンβ1の“脚”の部分が大きく広がるような構造変化が生じることが示されました(図2)。また、この構造変化の引き金となるラミニンのγ鎖のC末端部分とインテグリンの間のピンポイントの結合を可視化することにも成功し、インテグリンを介したシグナル伝達の分子メカニズムが明らかになりました。さらに、複合体の構造と構造情報に基づく生化学的解析により、インテグリンα6の上部とラミニン511の底部の間に形成される広い範囲での静電相互作用が、両者の結合において極めて重要であることが分かりました。この静電相互作用は、結合特異性の獲得に関与するだけでなく、結合の初期段階において離れた位置にいる両者が、互いを引き寄せ合う上でも重要な働きをしていると考えられます。
本研究において、インテグリンα6β1の単独の構造だけでなくラミニン511との複合体の構造も得られたことで、インテグリンとラミニンの結合前後の構造情報が全てそろいました。これにより、インテグリンによるラミニンの認識機構とシグナル伝達機構の理解が一気に進み、その全容解明に大きく前進したと言えます。
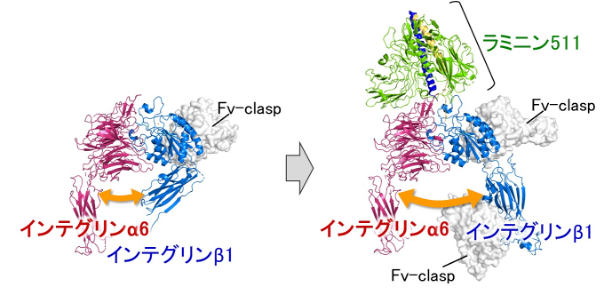
図2. インテグリンα6β1の結晶構造(左)とインテグリンα6β1-ラミニン511複合体のクライオ電子顕微鏡構造(右)
本研究成果が社会に与える影響(本研究成果の意義)
ES細胞やiPS細胞といった多能性幹細胞の表面にはインテグリンα6β1が多く存在し、ラミニン511をこれらの細胞を接着培養する際に足場(培養基質)として用いると、効率よく培養できることが知られています。ラミニン511は、既に多能性幹細胞の培養基質として実際に広く利用されていますが、本研究により、インテグリンα6β1を活性化させる際のラミニン511のはたらきが明らかになったことから、より効率的な、あるいはより安価な培養基質の開発が可能になることが期待され、再生医療に大きく貢献すると考えられます。
特記事項
本研究成果は、2021年6月29日(火)18時(日本時間)に米国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“Structural mechanism of laminin recognition by integrin”
著者名:Takao Arimori, Naoyuki Miyazaki, Emiko Mihara, Mamoru Takizawa, Yukimasa Taniguchi, Carlos Cabañas, Kiyotoshi Sekiguchi, and Junichi Takagi
用語説明
- 基底膜
ラミニン、IV型コラーゲン、パールカン、ニドゲンなどから構成される薄いシート状の構造体。細胞を配置するための支持体として機能し、細胞の遊走・増殖に必要な足場を提供する。
- ラミニン
α鎖、β鎖、γ鎖からなるヘテロ3量体の蛋白質。α鎖は5種、β鎖とγ鎖はそれぞれ3種ずつ存在し、少なくとも16種類の分子が存在することが知られている。基底膜の主要な構成分子であり、インテグリンとの結合を介して細胞の増殖や機能維持に必要な情報を伝達する。多能性幹細胞の培養時には、培養基質として利用されている。
- インテグリン
α鎖、β鎖からなるヘテロ2量体の細胞表面受容体。α鎖は18種、β鎖は8種存在し、これらの組み合わせが異なる24種類の分子の存在が知られている。リガンド特異性により、ラミニン受容体、RGD受容体、コラーゲン受容体、白血球特異的受容体に大別される。
- 細胞外マトリックス蛋白質
細胞の外の空間を埋め、細胞接着の足場となる蛋白質。ラミニンの他に、コラーゲン、フィブロネクチンなどが知られている。
