肥満に影響する遺伝マーカーを解明
日本人17万人の解析により肥満に関わる病気や細胞を同定
要旨
理化学研究所(理研)統合生命医科学研究センター(久保充明副センター長)、統計解析研究チームの鎌谷洋一郎チームリーダー、大阪大学大学院医学系研究科遺伝統計学の岡田随象教授らの共同研究グループ は、東北大学東北メディカル・メガバンク機構の山本雅之機構長ら、岩手医科大学いわて東北メディカル・メガバンク機構の清水厚志部門長代理ら、国立がん研究センター社会と健康研究センターらと共同で日本人約16万人の遺伝情報を用いた大規模なゲノムワイド関連解析(GWAS) と日本人約1.5万人による再現性の検証、ならびに欧米人約32万人との民族横断的解析を行い、体重調節に関わるヒトゲノム上の193の遺伝的変異(感受性領域)を同定しました。
肥満 はさまざまな病気の発症リスク因子であり、その原因は食べすぎや運動不足だけではなく、遺伝的な影響も大きいことが知られています。しかし、遺伝要因が体重の個人差をもたらす生物学的なメカニズムについては、十分に解明されていません。
今回、共同研究グループ はバイオバンク・ジャパン に参加した日本人約16万人の遺伝情報を用いてGWASを実施し、さらに欧米人約32万人で行われたGWASとのメタ解析 を行うことにより、体重に影響すると考えられる193のゲノム上の感受性領域を同定しました。このうち、112領域は初めて同定されたものです。また、組織特異的なエピゲノム情報 とGWASの統合解析により、過去に報告されていた脳の細胞に加えて、免疫細胞のリンパ球が体重調節において主要な役割を果たすことを示す複数の遺伝学的な証拠を見いだしました。さらに、GWASの結果を用いて、33の病気と体重の遺伝的な関わりを評価したところ、2型糖尿病や心血管病などの生活習慣病だけでなく、精神疾患、免疫・アレルギー疾患、骨関節疾患における遺伝要因と体重の個人差に関わる遺伝的因子との間に共通性があることを見いだしました。
本研究は、体重の個人差に影響する遺伝要因について、遺伝学的な知見だけでなく、体重と病気との関わりや、生物学的に関連する組織や細胞型など広範な視点から新しい知見を提供するものです。今後、体重に関わる幅広い科学分野での研究の発展に寄与するものと期待できます。
なお、本研究で利用したバイオバンク・ジャパンのサンプルの遺伝情報は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)を通じて公開されます (注1) 。これらのデータを世界中の研究者が利用可能になることで、さらなる研究成果につながると考えられます。
本研究成果は、国際科学雑誌『Nature genetics』に掲載されるのに先立ち、オンライン版(9月11日付け:日本時間9月12日)に掲載されました。
本研究は、日本医療研究開発機構の「オーダーメイド医療の実現プログラム」の支援のもと行われました。本研究で使用したサンプルは、「オーダーメイド医療の実現プログラム」、「東北メディカル・メガバンク計画 」、「多目的コホートに基づくがん予防など健康の維持・増進に役立つエビデンスの構築に関する研究(JPHC Study) 」において収集されたものです。
2017年2月21日東北メディカル・メガバンク機構プレスリリース「1万人分のSNPアレイ情報の分譲を開始」
http://www.megabank.tohoku.ac.jp/news/19784
背景
肥満はさまざまな病気の発症リスク因子であり、肥満の予防は健康増進に大きな役割を果たします。一人一人の体重は遺伝要因と環境要因が複雑に絡み合って決まりますが、過去の双生児を用いた研究成果から、体重の個人差の原因の4割から6割程度は遺伝要因によると考えられています (注2) 。
これまでに、世界では最大約34万人を対象としたゲノムワイド関連解析(GWAS)が行われ、体重に影響すると考えられる100程度のゲノム上の感受性領域が同定されました (注3) 。しかし、過去の大規模な研究は欧米人が主な対象でした。2012年に本研究グループがアジア人を主な対象とした研究成果を報告しましたが (注4) 、比較的小規模なものに限られていました。ゲノム情報は集団によって異なるため、欧米人以外の集団による研究は新たな知見をもたらす可能性が高いと考えられています。
また、これまでに同定された体重に関する遺伝要因は、脳で機能する遺伝子に影響することが繰り返し示唆されてきました。一方、生物学的研究では、免疫系細胞や脂肪細胞による肥満への関与が報告されていました。しかし、過去に実施されたGWASの結果を用いた解析では、これらの細胞型と肥満との関わりは明らかになっていませんでした。
(注3)Locke, A. E. et al. Genetic studies of body mass index yield new insights for obesity biology. Nature 518, 197–206(2015).
(注4)Okada, Y. et al. Common variants at CDKAL1 and KLF9 are associated with body mass index in east Asian populations. Nat. Genet. 44, 302–6 (2012).
研究手法と成果
共同研究グループはまず、バイオバンク・ジャパンに参加した日本人約16万人の遺伝情報を用いてGWASを行い、ゲノム上の体重に関わるマーカーを検索しました (図1) 。そして、GWASとは独立した日本人集団約1.5万人(東北メディカル・メガバンク計画のコホート調査、またはJPHC Studyに参加)の遺伝的変異情報を理研で測定し、体重への関連が示唆されたマーカーの再現性を評価しました。その結果、日本人の体重に影響すると考えられる85の感受性領域を同定しました。このうち51領域は今回初めて発見された領域です。
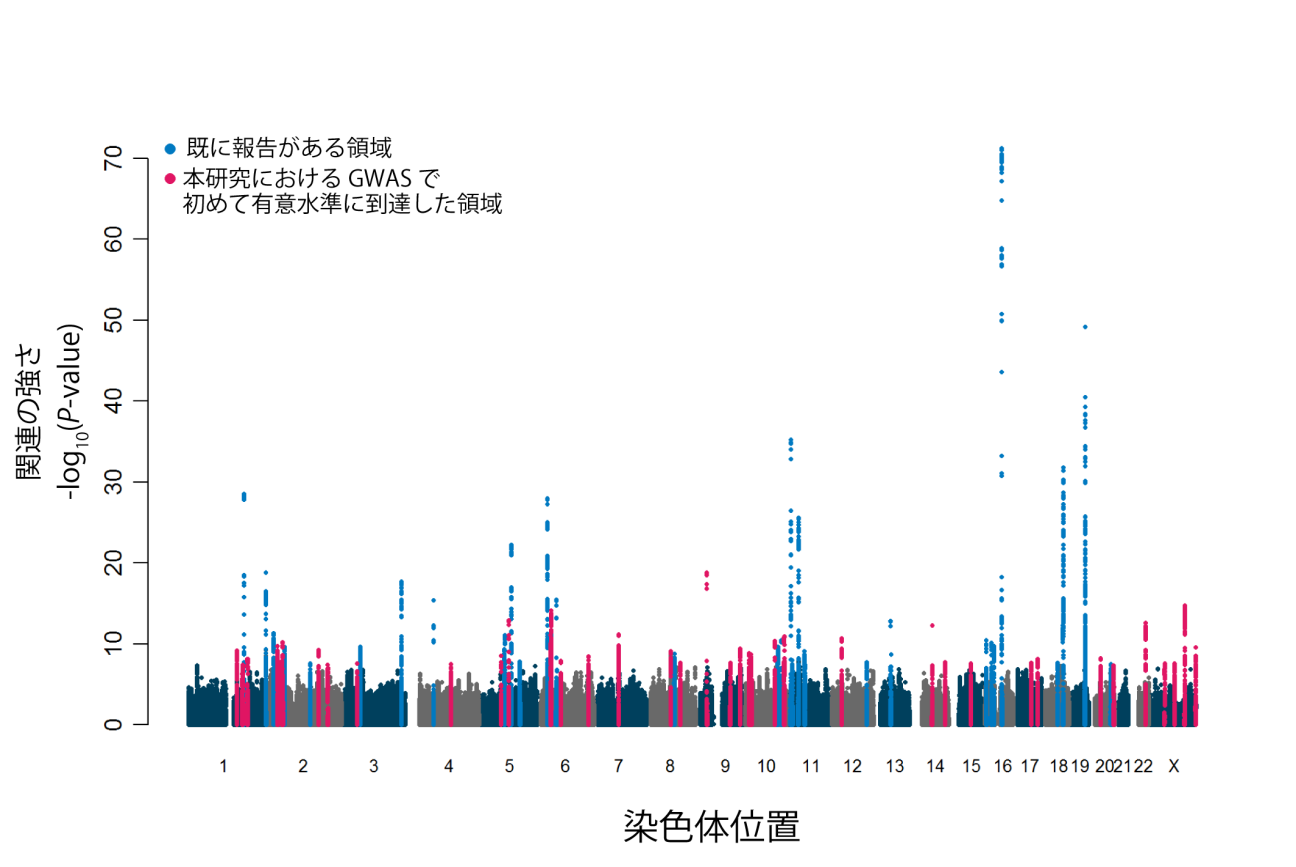
図1 本研究で実施した日本人集団のGWASのマンハッタンプロット
バイオバンク・ジャパンに参加した日本人約16万人の遺伝情報を用いて実施したGWASの結果。図では、横軸が染色体上の位置を示しており、縦軸にはSNPの関連の強さが示される。GWASの有意水準を超えた領域は、水色とピンクで色付けされており、水色は過去の研究で報告された領域、ピンクは今回のGWASで初めて有意な関連が観察された領域である。
さらに、約16万人の日本人で実施したGWASの結果と約32万人の欧米人で実施されたGWASの結果を、民族間での違いを考慮したメタ解析の手法であるMANTRA を用いて統合したところ、日本人と欧米人の体重に影響すると考えられる170の感受性領域を同定することに成功しました。このうち61領域は今回初めて発見されました。本研究は、現時点でアジア人を対象とした遺伝学研究において最大規模であり、欧米人の結果との統合により約48万人に由来するビッグデータの解析となりました。日本人単独での解析で同定された領域も含めると、体重に影響すると考えられるヒトゲノム上の193の遺伝的変異(感受性領域)が、本研究で明らかになりました。
次に、遺伝要因が日本人の体重の個人差にどの程度影響しているかを評価しました。今回同定された85の感受性領域だけでは、今回調べた日本人集団の体重の個人差の約3%を説明することができる程度です。しかし、今回検索を行った約600万カ所に及ぶ全ゲノムの一塩基多型(SNP) 情報を用いた解析により、最大で日本人集団の体重の個人差の約30%がSNPから説明可能であると推定されました。この結果から、現時点では同定可能な遺伝要因のうち約10%が解明されたと考えられます (図2) 。

図2 本研究の解析で説明できる体重の個人差に関する遺伝要因
①:過去の双生児を用いた研究成果から集団内の体重の個人差の原因の40~60%割程度は遺伝要因と考えられる。
②:本研究で検索を行った約600万カ所に及ぶ全ゲノムの一塩基多型(SNP)解析では最大で日本人集団の体重の個人差の約30%がSNPから説明可能であると推定された。
③:一方で今回同定した日本人の体重に影響する85の感受性領域だけでは、日本人集団の体重の個人差の約3%を説明することができる程度である。
②と③を勘案し、③は②の10%に相当することから、現時点では同定可能な遺伝要因のうち約10%が解析されたと考えられる。
また、バイオバンク・ジャパンのGWASと欧米人のGWASのどちらが、日本人の体重の個人差をより説明することが可能かを検証しました。この結果、過去に実施された約32万人の欧米人GWASよりも、今回実施した約16万人の日本人GWASの方が、日本人の体重の個人差を約1.8倍の精度で説明できることが分かりました。
続いて、同定された体重の個人差に関係する遺伝的変異(感受性領域)の生物学的役割を検討しました。体重のように誰にでもみられるような特徴の違いに関わる遺伝的変異は、タンパク質の性質そのものを変えたり産生できなくするといった生体へ強く影響する決定的な変異(タンパク質コード領域の変異)ではなく、タンパク質の量を少しだけ増減させるような変異(遺伝子調節領域 における変異)がほとんどであると考えられています。ゲノム配列はヒトの全細胞でほぼ同じですが、遺伝子調節領域は組織・細胞型ごとに異なるため、体重の個人差に関わる遺伝的変異は体重調節に関わる組織・細胞型の遺伝子調節領域に集中していると考えられます。GWASにより同定された遺伝的変異が集中している組織・細胞型がそのGWASが対象とする形質のメカニズムに関わる主要な組織・細胞型であることは、近年の統計学的解析で既に応用され有用であることが実証されています (注5 , 注6) 。
まず、公共データベースのエピゲノム情報から推定された遺伝子調節領域について検討したところ、アクティブエンハンサー の組織・細胞型特異性が最も高いことが確認されました。その上で、体重の変動に関わる遺伝的変異は脳(中枢神経系)細胞のみならず、免疫系細胞や脂肪組織のアクティブエンハンサーに統計学的有意に集中していることを証明しました。このうち、免疫系細胞・脂肪組織に体重調節に関わる遺伝的変異が集積していることは初めて分かりました( 図3 a)。
さらに詳しく解析すると、免疫系細胞の中でも特にBリンパ球 の遺伝子調節領域に遺伝的変異が集積していることが示されました( 図3 b)。別の遺伝子調節領域のプロモーター を示すエピゲノム情報のヒストンH3リジン4トリメチル化(ヒストンH3の4番目のリジンをトリメチル化する)をマーカーとして用いた解析においても、同様にBリンパ球における遺伝子調節の個人差が体重の個人差に影響することが再現されました。また、バイオバンク・ジャパンで実施された血球数のGWASとの遺伝学的相関 を評価したところ、体重の個人差に影響する遺伝要因は、ヒト血液中のリンパ球数に影響を及ぼす遺伝要因と一部共通していることが統計学的に示されました。これらの結果から、体重の個人差に関わる遺伝要因の一部は、Bリンパ球内での遺伝子の発現量の調整と、リンパ球数の量的な調整に影響していると考えられます。
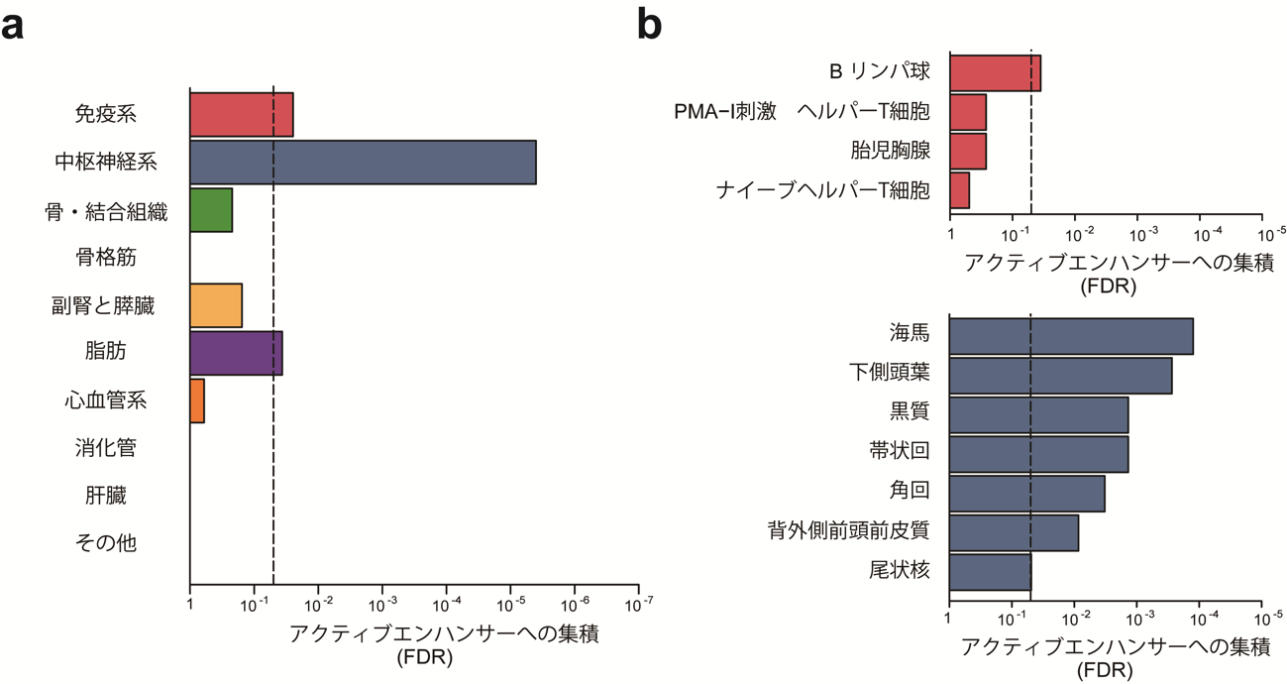
図3 アクティブエンハンサーを用いた体重の組織・細胞特異性解析
日本人と欧米人のGWASメタ解析の結果を用いて、強い関連が観察された遺伝的変異の組織特異的と考えられるアクティブエンハンサーへの集積を評価した。横軸は、多重検定を考慮した偽発見率(false discovery rate [FDR])を示す。
a)64の組織・細胞種のアクティブエンハンサー情報を10のグループに統合した結果、免疫系、中枢神経系、脂肪組織で統計学的に有意な集積が認められた。
b)上段は、免疫系細胞について個別に評価を行った結果。下段は、中枢神経系組織を部位別に評価した解析の結果。免疫性細胞ではBリンパ球で、中枢神経系組織では海馬、下側頭葉、異質、帯状回、角回、背外側前頭前皮質で統計学的に有意な集積が認められた。
最後に、これまでに理研で実施した33の病気を対象にしたGWASと今回の体重のGWASの結果を用いて遺伝学的相関を評価し、生まれ持った太りやすさや痩せやすさが発症に影響する病気を検索しました。この結果、九つの病気が体重と遺伝的な相関があることが分かりました (図4) 。過去の研究で、2型糖尿病や心筋梗塞などの心血管病が体重と遺伝的な相関があることは報告されていましたが、骨や関節の病気(後縦靭帯骨化症、思春期特発性側弯(そくわん)症)、精神疾患(統合失調症)、免疫やアレルギーが関わる病気(関節リウマチ、気管支喘息)などの病気が、生まれ持った太りやすさや痩せやすさと関係していることも分かりました。
これらの結果から、痩せ型の人は遺伝的に関節リウマチ、思春期特発性側弯症、統合失調症を発症するリスクが高く、肥満の人は2型糖尿病や心血管疾患(脳梗塞、心筋梗塞、閉塞性動脈硬化症)だけでなく、気管支喘息や後縦靭帯骨化症の発症リスクが高いことが示唆されます。これまで体重と病気の関係は、疫学研究や臨床研究からも、本研究が示したものと類似の関係性が示唆されていましたが、関節リウマチや統合失調症における体重と病気の関係は不明でした。これらの知見は、将来的に病気の発症予防の対策に役立つ可能性があると考えられます。
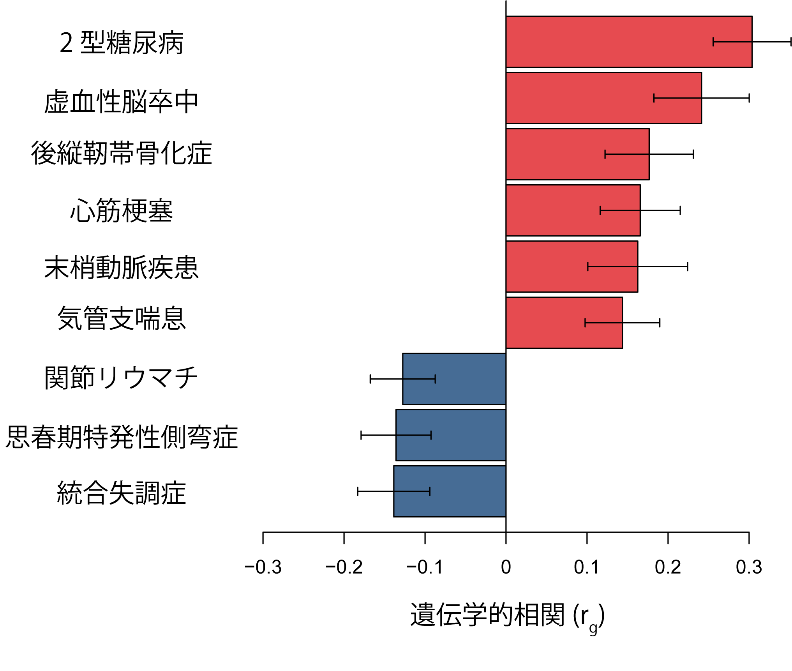
図4 体重と病気の遺伝学的相関
バイオバンク・ジャパンで実施した体重のGWASを用いて33の病気との遺伝学的相関を評価したところ、九つの病気と統計学的に有意な相関があった。横軸は、rqという遺伝学的相関の強さを示しており、正の値(赤棒)は正の相関、すなわち生まれつき太りやすい人がかかりやすい病気、負の値(青棒)は負の相関、すなわち生まれつき痩せやすい人がかかりやすい病気であることを示している。
(注5) Trynka, G. et al. Chromatin marks identify critical cell types for fine mapping complex trait variants. Nat. Genet. 45, 124–30 (2013).
(注6) Finucane, H. K. et al. Partitioning heritability by functional annotation using genome-wide association summary statistics. Nat. Genet. 47, 1228–35 (2015).
今後の期待
本研究成果は、体重の個人差に影響する遺伝要因について、遺伝学的な知見だけでなく、体重と病気との関わりや、生物学的に関連する組織や細胞型など広範な視点から新しい知見を提供するものです。今後、体重に関わる幅広い科学分野での研究の発展に寄与するものと期待できます。なお、本研究で利用したバイオバンク・ジャパンのサンプルの遺伝情報は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)を通じて公開されます。これらのデータを世界中の研究者が利用可能になることで、さらなる研究成果につながると考えられます。
特に、免疫系細胞において、遺伝要因がどのような生物学的な機序で体重の違いに影響するかはほとんど分かっていません。今後“免疫細胞における遺伝子調節機構がどのようにして体重の個人差をもたらすのか”ということに着目した研究が進んでいくと考えられます。
論文情報
<タイトル>
Genome-wide association study identifies 112 loci for body mass index in the Japanese population
<著者名>
Masato Akiyama, Yukinori Okada, Masahiro Kanai, Atsushi Takahashi, Yukihide Momozawa, Masashi Ikeda, Nakao Iwata, Shiro Ikegawa, Makoto Hirata, Koichi Matsuda, Motoki Iwasaki, Taiki Yamaji, Norie Sawada, Tsuyoshi Hachiya, Kozo Tanno, Atsushi Shimizu, Atsushi Hozawa, Naoko Minegishi, Shoichiro Tsugane, Masayuki Yamamoto, Michiaki Kubo and Yoichiro Kamatani.
<雑誌>
Nature genetics
<DOI>
10.1038/ng.3951
共同研究グループ
理化学研究所 統合生命医科学研究センター 副センター長 久保充明(くぼみちあき)
統計解析研究チーム チームリーダー 鎌谷洋一郎(かまたによういちろう) リサーチアソシエイト 秋山雅人(あきやままさと) 客員研究員 高橋篤(たかはしあつし) (国立循環器病研究センター研究所 病態ゲノム医学部部長)
基盤技術開発研究チーム チームリーダー 桃沢幸秀(ももざわゆきひで)
骨関節疾患研究チーム チームリーダー 池川志郎(いけがわしろう)
大阪大学大学院医学系研究科 遺伝統計学 教授 岡田随象(おかだゆきのり) 大学院生 金井仁弘(かないまさひろ)
<サンプル提供機関>
東京大学医科学研究所 シークエンス技術開発分野 特任助教 平田真(ひらたまこと)
東京大学大学院新領域創成科学研究科 クリニカルシークエンス分野 教授 松田浩一(まつだこういち)
国立がん研究センター 社会と健康研究センター センター長 津金昌一郎(つがねしょういちろう)
疫学研究部 部長 岩崎基(いわさきもとき) 室長 山地太樹(やまじたいき) 室長 澤田典絵(さわだ のりえ)
岩手医科大学 いわて東北メディカル・メガバンク機構 生体情報解析部門 部門長代理 清水厚志(しみずあつし) 副部門長 八谷剛史(はちやつよし)
臨床研究・疫学研究部門 副部門長 丹野高三(たんのこうぞう)
東北大学 東北メディカル・メガバンク機構 機構長 山本雅之(やまもとまさゆき)
予防医学・疫学部門 教授 寳澤篤(ほうざわ あつし)
バイオバンク部門 教授 峯岸直子(みねぎしなおこ)
藤田保健衛生大学 医学部 精神科 教授 岩田仲生(いわたなかお) 准教授 池田匡志(いけだまさし)
参考URL
大阪大学大学院医学系研究科・遺伝統計学
http://www.sg.med.osaka-u.ac.jp/index.html
用語説明
- ゲノムワイド関連解析(GWAS)
疾患や身長・体重などの量的な形質に影響があるゲノム上のマーカーを、網羅的に検索する手法。2002年に、理研が世界に先駆けて報告を行っており、以降、さまざまな疾患や量的形質に関連するゲノムマーカーの同定に貢献している。GWASはGenome-wide association studyの略。
- 肥満
肥満を表す指標としてBMI(Body Mass Index)が世界的に広く用いられており、BMI = 体重(kg)÷{身長(m)×身長(m)}で表される。日本では、BMI25以上が肥満とみなされる。本研究では、肥満や体重の違いの指標として、BMIを表現型とし関連解析を実施した。
- バイオバンク・ジャパン
アジア最大の生体試料バンクで、東京大学医科学研究所内に設置されている。オーダーメイド医療の実現プログラムの基盤であり、約20万人の日本人から収集したDNAや血清サンプルを臨床情報とともに厳重に保管し、研究者への試料やデータの提供を行っている。
- メタ解析
メタ解析、MANTRA:
別々の解析から得られた統計量を集約し、統合する統計学的手法。本研究では、日本人と欧米人の結果を統合する際、人種間における頻度や効果サイズの違いを考慮できるMANTRAというベイズ推定を応用した手法を用いて、メタ解析を実施した。
- エピゲノム情報
ゲノムに施された後天的なメチル化やアセチル化などの修飾の総称。
- 東北メディカル・メガバンク計画
東日本大震災の被災地を含む地域で長期健康調査を行い、被災地の健康状態の改善及び、遺伝要因・環境要因を考慮した次世代型医療・予防の確立を目標とした計画。日本医療研究開発機構(AMED)の支援を受け、東北大学東北メディカル・メガバンク機構と岩手医科大学いわて東北メディカル・メガバンク機構とが連携して事業を実施している。詳細は http://www.megabank.tohoku.ac.jp/ 、 http://iwate-megabank.org/ 参照
- 多目的コホートに基づくがん予防など健康の維持・増進に役立つエビデンスの構築に関する研究(JPHC Study)
多目的コホート研究(JPHC Study):
「多目的コホートに基づくがん予防など健康の維持・増進に役立つエビデンスの構築に関する研究」(主任研究者 津金昌一郎 国立がん研究センターがん予防・検診研究センター長)において全国11保健所と国立がん研究センター、国立循環器病研究センター、大学、研究機関、医療機関などとの共同研究として行われている。詳細は http://epi.ncc.go.jp/jphc/ 参照。
- 一塩基多型(SNP)
ゲノムの個人間の違いのうち、集団での頻度が1%以上存在するものを遺伝的多型と呼び、代表的なものとして、A、C、T、Gからなるヒトゲノム塩基配列上の一カ所の違いが一塩基多型と定義される。SNPはSingle Nucleotide Polymorphismの略。
- 遺伝子調節領域
遺伝子の転写を調節するエンハンサー、プロモーター、サイレンサーなどのゲノム領域のこと。
- アクティブエンハンサー
ヒストンのメチル化やアセチル化の状態から、転写因子との結合によって遺伝子の発現量に影響するエンハンサー活性が高いと考えられるゲノム上の塩基配列のこと。本研究では、国際コンソーシアムのRoadmap epigenomic projectが公開しているExpanded 18 state modelで推定された情報を用いた。
- Bリンパ球
生体防御に重要な役割を果たしているリンパ球の一種。リンパ球は白血球の一種で、体に侵入してきた異物を認識して、それらを排除するためのタンパク質である抗体を作り出す。
- プロモーター
遺伝子の近くに存在し、遺伝子発現機能を持つゲノム上の塩基配列。
- 遺伝学的相関
二つの形質の遺伝的な背景がどの程度類似しているかを、定量的に評価する手法。本研究では、LDスコア回帰(LD score regression)という手法により、全ゲノムの情報を用いて遺伝学的相関の評価を行った。
