アルファ線を放出するナノ粒子による安定・安全ながん治療薬
病巣に直接注入することで限局的な超低被ばくの治療が可能に
研究成果のポイント
概要
大阪大学大学院医学系研究科放射線統合医学講座核医学の加藤弘樹准教授、同理学研究科天然物有機化学研究室および大阪大学放射線科学基盤機構の合同チームは、アルファ線を放出する核種アスタチン211(211At)をがんの病巣に直接投与して治療を行う薬剤を開発しました。
放射線(X線、ガンマ線)を用いたがんの治療は有効で広く行われていますが、がん以外の正常な組織にも放射線が照射されることによって、副作用が生じます。アルファ線は、X線、ガンマ線と比較してさらに強力な放射線であり、最近、がん細胞に対して非常に強い殺傷効果があることが報告されています。一方、アルファ線は体内での飛程が大変短いため、放射線源をがん細胞の内部にまで到達させなければ効果が期待できません。そのため、がんに集積しやすい薬剤にアルファ線核種を標識し、全身に投与する治療法が開発されています。しかしながら、この方法は全身の正常組織にも薬剤が集積し、アルファ線が照射されるため、やはり一定の副作用が生じてしまいます。
今回、研究チームは、短い半減期で高エネルギーのアルファ線を放出することができるアスタチン211(211At)を、体にほぼ無害な金ナノ粒子(AuNP)に結合し、それを局所投与することによって腫瘍内に限局的に拡散させる治療法を開発しました(図1)。その結果、本研究で開発したアスタチン標識金ナノ粒子は、非常にシンプルな構造ながら、がんの種類によらない効果をもつ、強力で安全な局所治療であることが確認されました。この治療は、開発した薬剤を悪性腫瘍に局所的に注入することによって、病巣に高い放射能を照射しがん細胞を殺傷します。その一方で、病巣以外にはほとんど影響を及ぼさず副作用がないため、安全な治療法です。
今後、転移していないがんに対して、汎用性が高く、安全で強力な治療法を提案できることが期待されます。
本研究成果は、英国科学誌「Journal of Nanobiotechnology」に、7月31日(土)17時(日本時間)に公開されました。
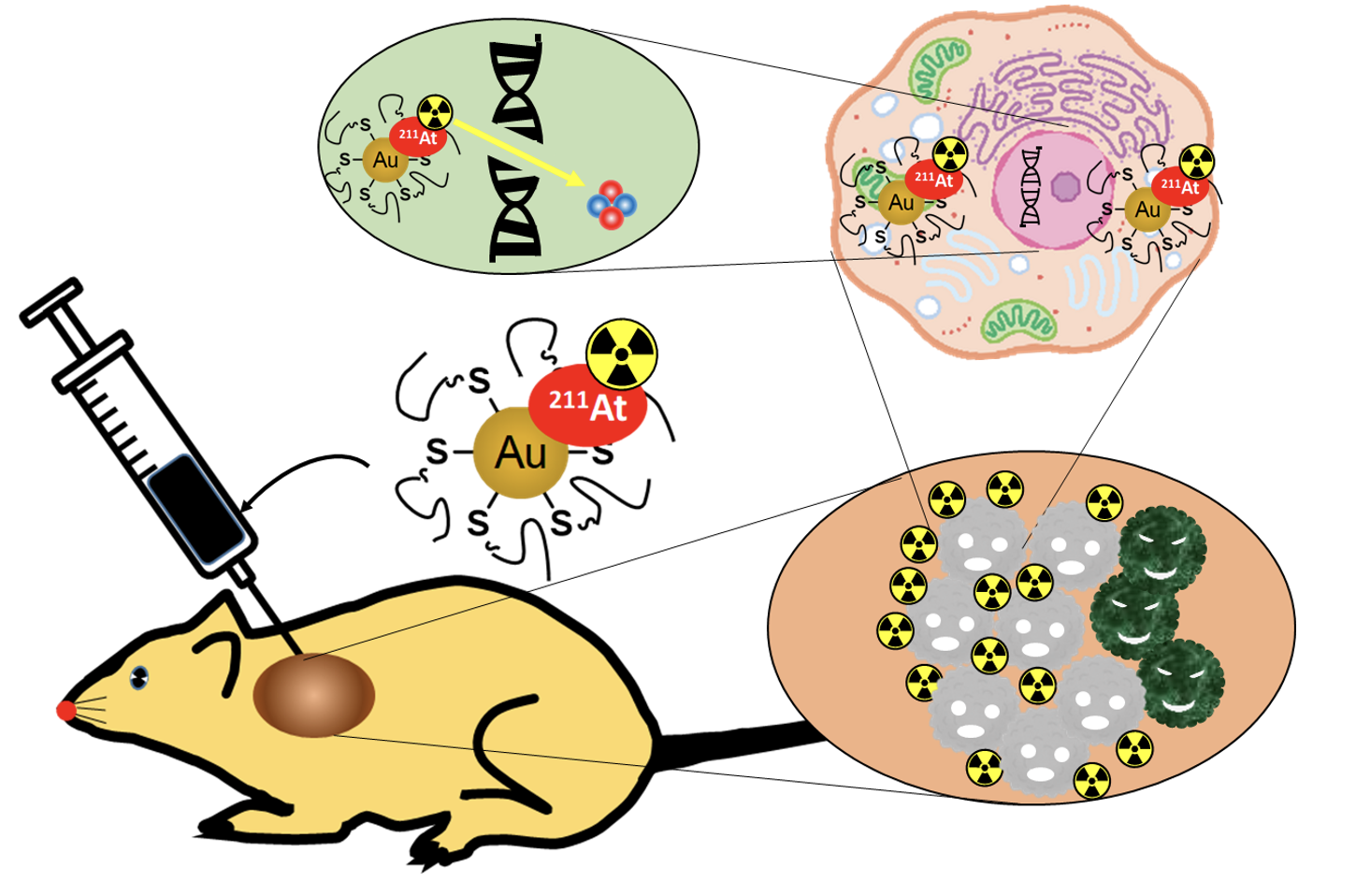
図1. がんに直接注入した薬剤は腫瘤内に拡がり、がん細胞内に侵入し、他には影響を及ぼさずがん細胞のDNAを破壊する。
研究の背景
がんの治療のひとつとして、ガンマ線あるいはX線の外照射に加えて、前立腺癌、乳癌、舌癌、子宮癌、頭頚部癌、そして最近海外では、脳腫瘍などに対して密封X線源を用いた小線源治療が行われています。X線あるいはガンマ線を体外から照射する外照射治療は、病巣より広い範囲に影響が及ぶため、正常組織の被ばくによる副作用が避けられません。一方、小線源治療はRIが密封されていて拡散しないため、正常組織への影響は外照射や標的核医学治療に比して少ないものの、X線の近接臓器への漏洩による副作用は無視できません。ベータ線、特にアルファ線核種は生体組織に与える影響が高く、DNAの2本鎖を断裂するため、特に増殖細胞に対して高い障害性があります。一方、アルファ線は飛程が大変短いため、線源を適切に分布させれば、正常組織の被曝はほとんどありません(図2)。この性質によって、X線あるいはガンマ線照射による前記副作用は大幅に低減されます。アルファ線放出核種で標識した微小サイズのseedを局所分散することによって、強力ながんの局所治療が可能になると考えられます。
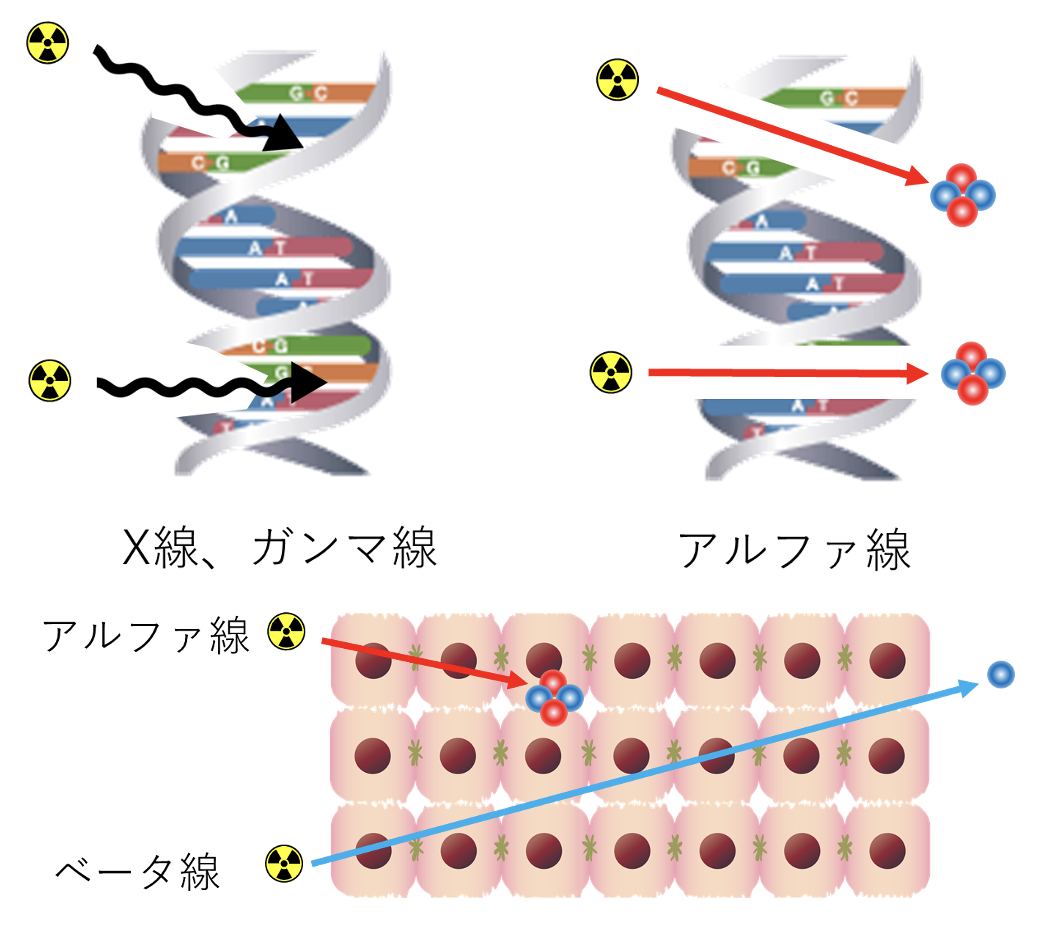
図2. X線、ガンマ線と比べてアルファ線はDNAの破壊力が大きく、アルファ線はベータ線と比較して生体組織中を飛ぶ距離が短い。
本研究の成果
研究グループでは、短い半減期で高エネルギーのアルファ線を放出することができるアスタチン211(211At)を、体にほぼ無害な金ナノ粒子(AuNP)に結合し、それを局所投与によって腫瘍内に限局的に拡散させる211At diffusible nanoseed brachytherapyを開発し、効果を検証しました。
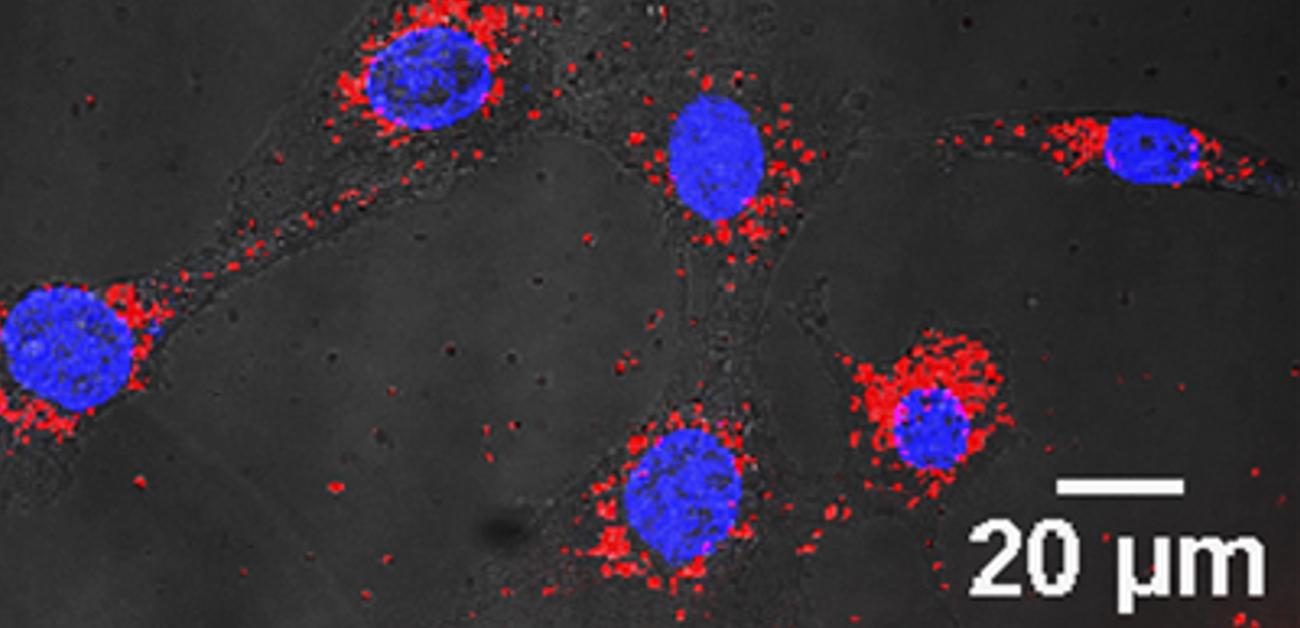
この治療法は、安定性、組織親和性を高めるためにAuNP表面をメトキシポリエチレングリコール(mPEG)で修飾した211At標識金ナノ粒子(211At-AuNP-S-mPEG)を、がんの腫瘤に直接注入し、がん組織の増殖を抑制する全く新しい治療法です。培養したグリオーマ細胞に、AuNP-S-mPEGを投与したところ、ナノ粒子が細胞内に取り込まれ内在化することが分かりました(図3)。ラットの皮下に移植したがん(グリオーマ)の腫瘍内に、211At-AuNP-S-mPEGを超音波ガイド下で投与したところ、腫瘍内には拡散するものの、腫瘍外の正常臓器にはほとんど集積しないことが明らかになりました(図4A)。211At-AuNP-S-mPEGを局所投与した腫瘍は、生理食塩水を投与した腫瘍と比べて増殖が非常に強く抑制されることが確認されました(図4B)。また、211At-AuNP-S-mPEGを投与した動物には体重変化がありませんでした。さらに、211At-AuNP-S-mPEGをマウスの皮下に移植したヒトの膵がんに局所投与したところ、薬剤はグリオーマ同様、膵がんの腫瘍のみに集積し、同様に非常に強い腫瘍増殖抑制効果を示しました。
本研究で開発したアスタチン標識金ナノ粒子は、非常にシンプルな構造ながら、がんの種類によらない効果をもつ、強力で安全な局所治療であることが確認されました。
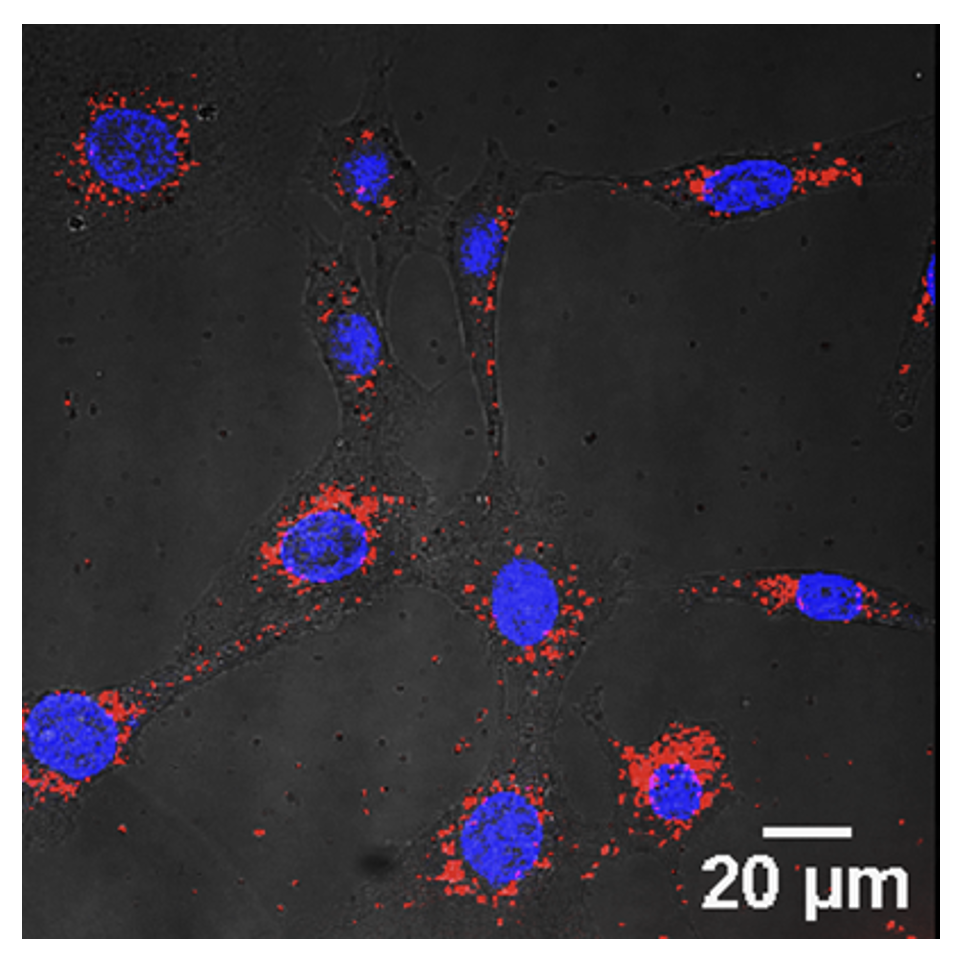
図3. 金ナノ粒子(赤)は細胞内在化し、核(青)周囲に集積する。
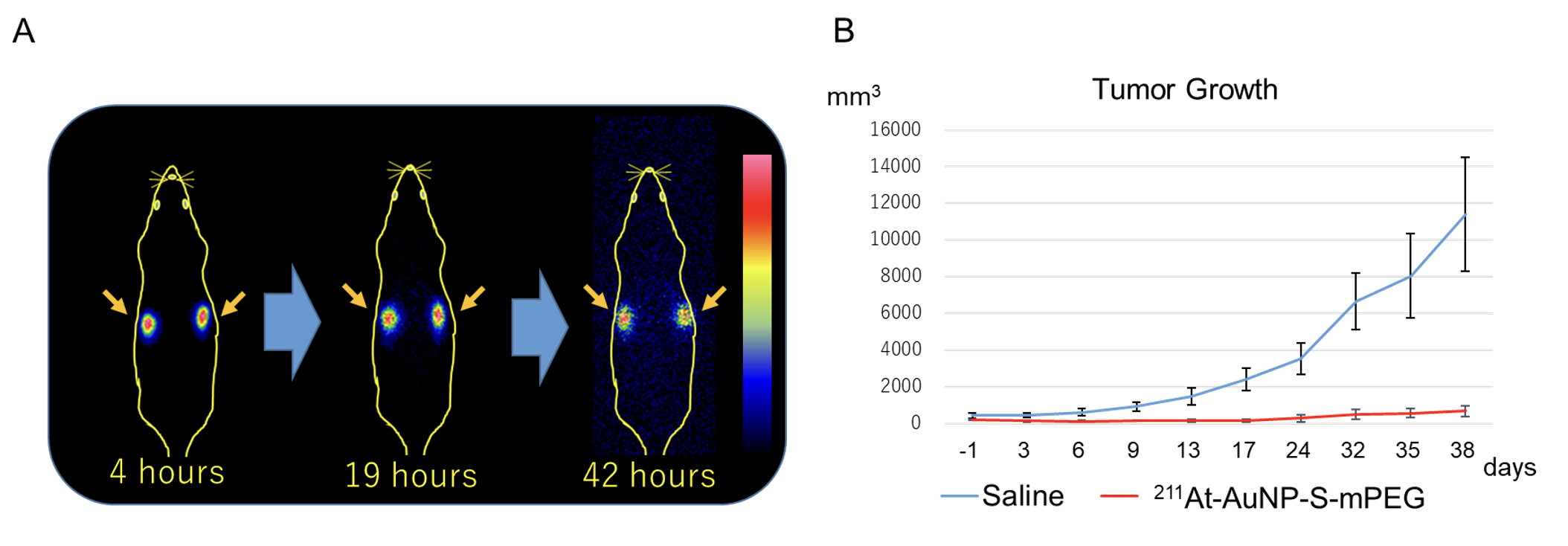
図4. (A)シンチグラフィーでは、薬剤注入後いずれのタイミングでも、放射能は腫瘍(矢印)にのみ認められ、その他には分布しない。
(B)アスタチン標識金ナノ粒子は腫瘍増殖を強く抑制する。(Saline:生理食塩水)
本研究成果が社会に与える影響(本研究成果の意義)
近年、アルファ線放出核種で標識した、悪性腫瘍標的薬剤が注目され、開発研究が盛んにおこなわれています。ほとんどすべてが、静脈を介して全身に分布させる薬剤であり、転移病変の治療も併せて行うことができる一方、標的外の集積は正常組織の被ばくにつながります。全身を対象とした治療に対して、光免疫療法の様な低侵襲で局所的な治療も大変期待されています。我々の提案するこの治療法は全く新しいがんの局所治療であり、強力な放射線治療を低侵襲で副作用なく行うことができます。また、金ナノ粒子は放射線治療の効果を増大させる増感剤でもあります。従って、この治療と放射線外照射治療を組み合わせることで、さらなる治療効果が期待できます。また、この治療は血流の少ない腫瘍、薬剤の届きにくい病変にも有効ですので、従来の化学療法と併せて行うことで相補的な効果が期待できます。さらに、この薬剤は非常にシンプルな構造で効果を発揮しますが、金ナノ粒子はさらに他の化合物を追加的に搭載できる余地がありますので、今後の研究によってさらなる用途の拡大が見込まれます。このように、本治療法は汎用性と発展性という点において、今後の癌治療に影響を与える新しい治療コンセプトです。
今後、臨床応用を検討する予定です。この薬剤は、口腔癌、皮膚がん、乳がん、消化器癌、そして脳腫瘍等、多くのがんに応用可能であり、現在、舌癌への応用に向けた検討を進めています。また、がんの腹膜播種や、がん摘出腔に対する再発予防のための薬剤散布治療への応用や、リンパ組織への投与によるリンパ節転移の治療への応用検討、さらには、抗体を搭載してがん特異性と治療効果をさらに高めた製剤の開発などを開始しています。
特記事項
本研究成果は、2021年7月31日(土)9時(英国時間)〔7月31日(土)17時(日本時間)〕に英国科学誌「Journal of Nanobiotechnology」(オンライン)に掲載されました。
【タイトル】 “Intratumoral administration of astatine-211-labeled gold nanoparticle for alpha therapy”
【著者名】 Hiroki Kato1, Xuhao Huang2, Yuichiro Kadonaga3, Daisuke Katayama1, Kazuhiro Ooe1, Atsushi Shimoyama2, Kazuya Kabayama2, Atsushi Toyoshima2, Atsushi Shinohara2,3, Jun Hatazawa4, Koichi Fukase2,3
【所属】
1. 大阪大学大学院医学系研究科 放射線統合医学講座 核医学
2. 大阪大学大学院理学研究科 天然物有機化学研究室
3. 大阪大学放射線科学基盤機構
4. 大阪大学核物理センター
DOI:https://doi.org/10.1186/s12951-021-00963-9
本研究では、羽場宏光博士、王洋博士(国立研究開発法人理化学研究所 仁科加速器科学研究センター)より、アスタチン211の供給を受けて行われました。
また、本研究は、科学研究費補助金・基盤研究(S)(2020年8月 – 2025年3月)(代表:深瀬浩一:大阪大学大学院理学研究科・教授:JP20H05675)、基盤研究(A)(2020年4月 - 2023年3月) (代表:深瀬浩一:大阪大学大学院理学研究科・教授:JP20H00404)、基盤研究(C)(2018年4月 – 2021年3月) (代表:加藤弘樹:大阪大学大学院医学系研究科・准教授:JP18K07674) 、量子アプリ共創コンソーシアム(QiSS)産学共創プラットフォーム共同研究推進プログラム(OPERA)(2017年度 - 2021年度)(代表:中野貴志:核物理研究センター・センター長:JPMJOP1721)の支援を得て実施したものです。211At はJSPS科研費16H06278の助成を受けた短寿命RI供給プラットフォームによって供給されました。ここに感謝の意を表します
用語説明
- アルファ線
放射線の一種で、ヘリウムの原子核による粒子線。エネルギーが高く、生体に照射した場合の生物学的影響は非常に大きい。一方、生体中での飛程が短いことも特徴。
- アスタチン211
アルファ線を放出する元素。半減期(放射線の量が半分になるまでに要する時間)は約7時間と、医療で使用される核種としては比較的短時間で減衰する。核燃料物質を用いず、加速器で生成できることも特徴。シンチグラフィーで画像化しやすい。
- 金ナノ粒子
金(Au)のコロイドでサイズが数100ナノメートル以下の微粒子。様々な分子と結合させることができ、医薬品の核としても注目されている。1970年代までシンチグラフィー用薬剤としても使用されたことがあり、人体への影響は非常に少ないと考えられている。
- シンチグラフィー
体内に投与した放射性同位体から放出される放射線を検出し、その分布を画像化すること。
