精子形成を維持するメカニズムの一端を解明
オートファジーを介した制御機構が明らかに
研究成果のポイント
概要
大阪大学大学院医学系研究科の山室禎 研究生(遺伝学)(研究当時、現ハーバード大学博士研究員)、中村修平 准教授(遺伝学/大学院生命機能研究科 細胞内膜動態研究室/高等共創研究院)、吉森保 教授(遺伝学/大学院生命機能研究科 細胞内膜動態研究室)のグループは大阪大学微生物病研究所の伊川正人 教授らと共同で、これまで十分に理解されていなかったセルトリ細胞による精子形成や維持に関わるメカニズムについて、セルトリ細胞のRubicon (Run domain Beclin-1 interacting and cysteine-rich containing protein)がオートファジーを制御し、精子形成を維持していることと、その背景にあるメカニズムを明らかにしました。
これまでに研究グループは、オートファジーの抑制因子であるRubiconが加齢に伴い蓄積すること、また、Rubiconを抑制してオートファジー活性を高くした個体は寿命が延びることを明らかにしました。一方で、脂肪組織においては、加齢に伴いRubiconが減少することでオートファジー活性が過剰になり、生活習慣病を引き起こすことも明らかにしています。
今回、研究グループは、オートファジーの抑制因子であるRubiconを全身で欠損させることによりオートファジー活性を高めたマウスでは、精巣重量が減少し、精子形成と妊孕性が低下することを見出しました(図1)。さらに、精巣の様々な細胞の中でも、セルトリ細胞のRubiconを欠損させた際に精子形成が低下することを発見しました。Rubiconを抑制すると、GATA4というセルトリ細胞に重要なタンパク質をオートファジーが分解・減少させてしまうことも分かりました。これにより、オートファジーの活性化がセルトリ細胞の機能を低下させ、男性不妊の一因になりうることが明らかになりました。今後、男性不妊の診断や治療に役立てられることが期待されます。
本研究成果は、米国科学誌「PLOS Genetics」に、8月6日(金)午前3時(日本時間)に公開されました。
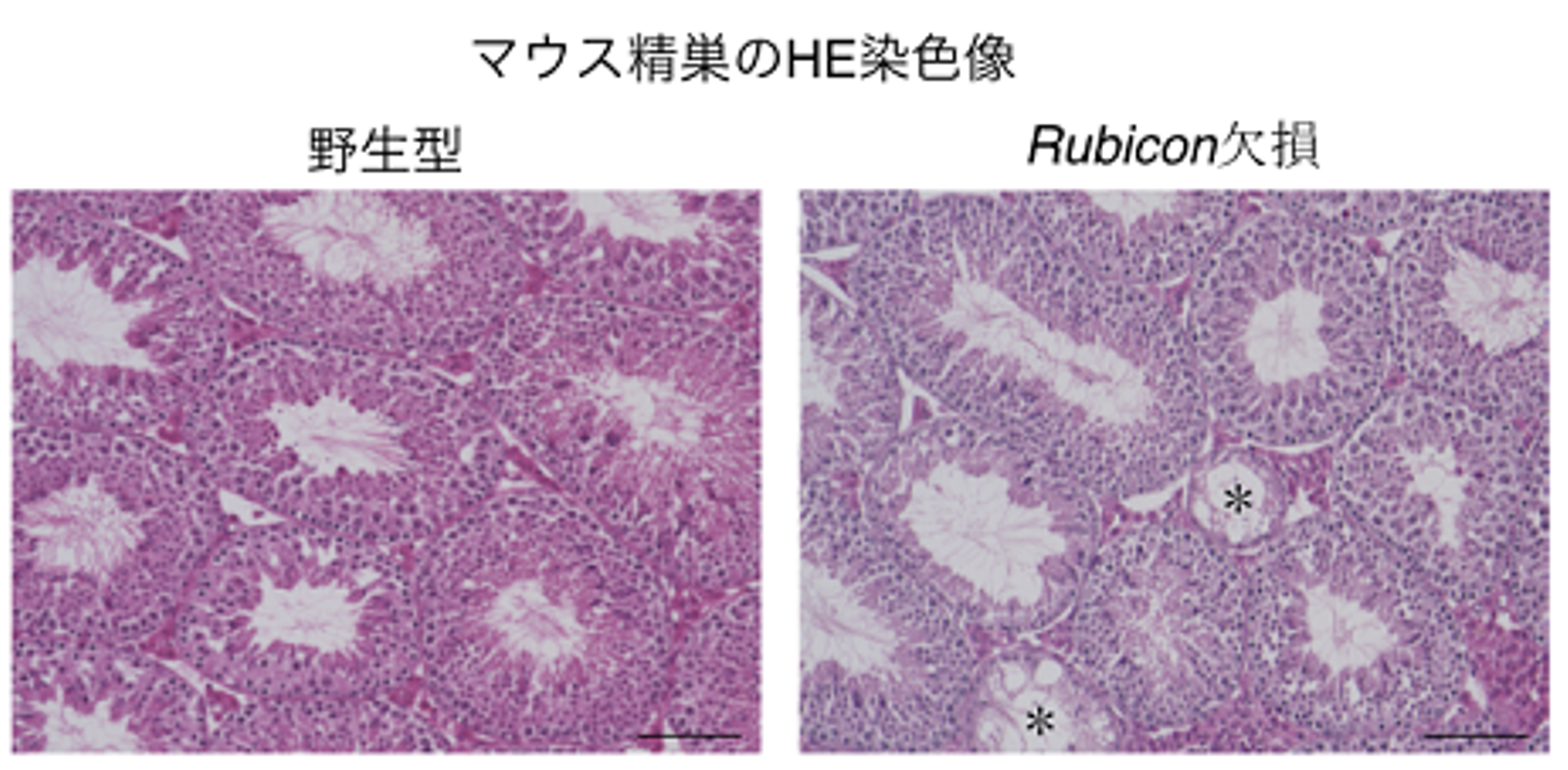
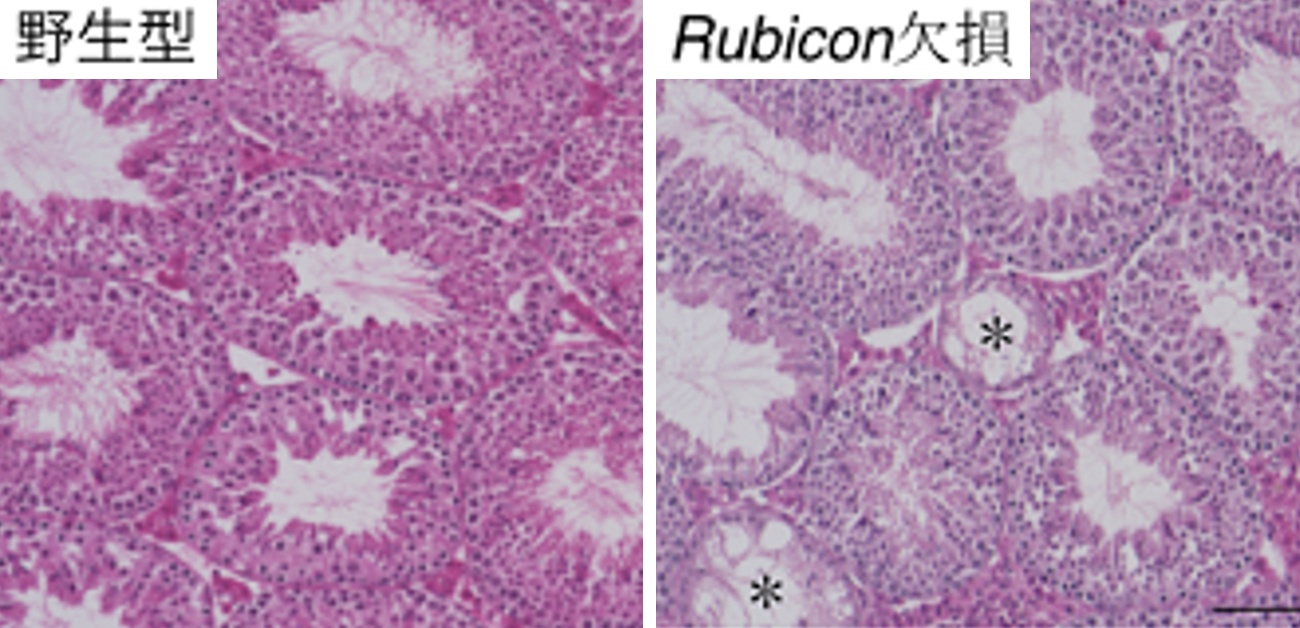
図1. 全身Rubicon欠損マウスでは精子形成が低下する
マウス精巣のヘマトキシリン・エオジン染色(HE染色)像を示す。*は精子の枯渇した箇所を示している。野生型と比較し、全身でRubicon遺伝子を欠損してオートファジー活性を増加させたマウスでは、精子形成が低下しているといえる。
研究の背景
精原幹細胞は自らを無数に複製し、その一部が精母細胞、精子細胞、精子の順に分化することで、精子形成が維持されています。セルトリ細胞は精子を形成していく細胞群を物理的・内分泌的にサポートし、これらの細胞の維持・分化に重要な働きをしています。これまでGATA4と呼ばれる転写因子がセルトリ細胞の機能に必須であることは分かっていましたが、GATA4がセルトリ細胞でどのように制御されているかは不明でした。
オートファジーは細胞内の不要物を分解・除去することで、細胞を健康に保っています。これまでの研究で、オートファジーの活性化はがんや神経変性疾患など、様々な疾患を抑制しうることが示されています。本研究グループの吉森教授と中村准教授は2019年に、オートファジーの抑制因子であるRubiconを欠損させてオートファジーを高めると、腎臓や神経系の加齢性疾患が改善することを明らかにしました(https://resou.osaka-u.ac.jp/ja/research/2019/20190219_2)。また、脂肪組織においては逆に、Rubiconを欠損させると糖尿病や脂肪肝が引き起こされることも示しました(https://resou.osaka-u.ac.jp/ja/research/2020/20200820_2)。その一方で、Rubiconの精巣や生殖腺の老化における役割や機序は未解明でした。
本研究の成果
まず、全身でRubiconを欠損させ、オートファジー活性を増加させたマウスの精巣を調べたところ、このマウスでは精巣重量が減少し、精子形成が低下していることが分かりました(図1)。さらに、精子運動能や妊孕性が低下していることも見出しました。正常なマウスではRubiconは精巣内のいずれの細胞にも存在していたため、どの細胞のRubiconが精子形成に重要なのか分かりませんでした。そこで精巣の遺伝子発現を解析したところ、全身でRubiconを欠損したマウスでは、セルトリ細胞に関わる遺伝子の発現のみ低下していることが判明しました。そのためセルトリ細胞のRubiconのみ欠損させたマウスを作成して調べたところ、精子形成が低下し、精原幹細胞の数も減少していました(図2)。これらの結果から、Rubiconはセルトリ細胞が精原幹細胞を維持する働きに必要であると考えられます。
さらに解析を進めたところ、Rubiconを欠損させたマウスでは、GATA4というセルトリ細胞に必須の転写因子がオートファジーによって分解されていることが判明しました。また、アンドロゲン(男性ホルモン)の働きを阻害する薬剤を投与すると、精巣内のRubiconやGATA4が減少することが明らかになりました。これらの結果から、アンドロゲンが精巣内のRubiconを一定に維持し、セルトリ細胞におけるGATA4のオートファジー分解を制御している可能性が示唆されます(図3)。子育て中の雄ではアンドロゲンが低下することが知られており、オートファジーがGATA4を分解することであえて妊孕性を低下させ、子育てに集中させる仕組みが備わっているのかもしれません。
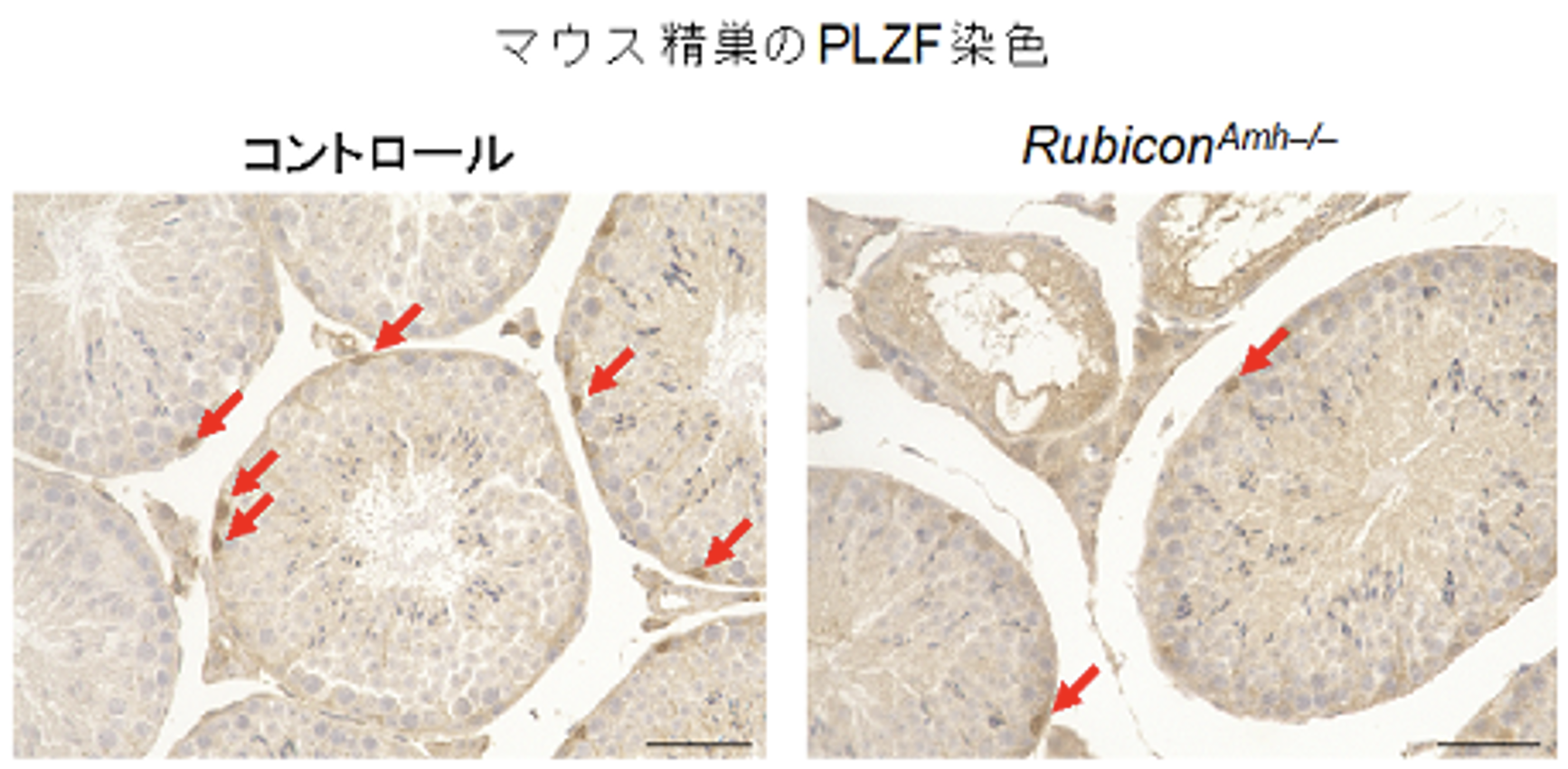
図2. セルトリ細胞でRubiconを欠損させたマウスでは精原幹細胞が減少する
マウス精巣のPLZF染色像を示す。PLZFは精原幹細胞のマーカーである。矢印は精原幹細胞を示している。コントロールと比較し、セルトリ細胞のRubicon遺伝子を欠損したマウス(RubiconAmh–/–マウス)では精原幹細胞が減少しているといえる。
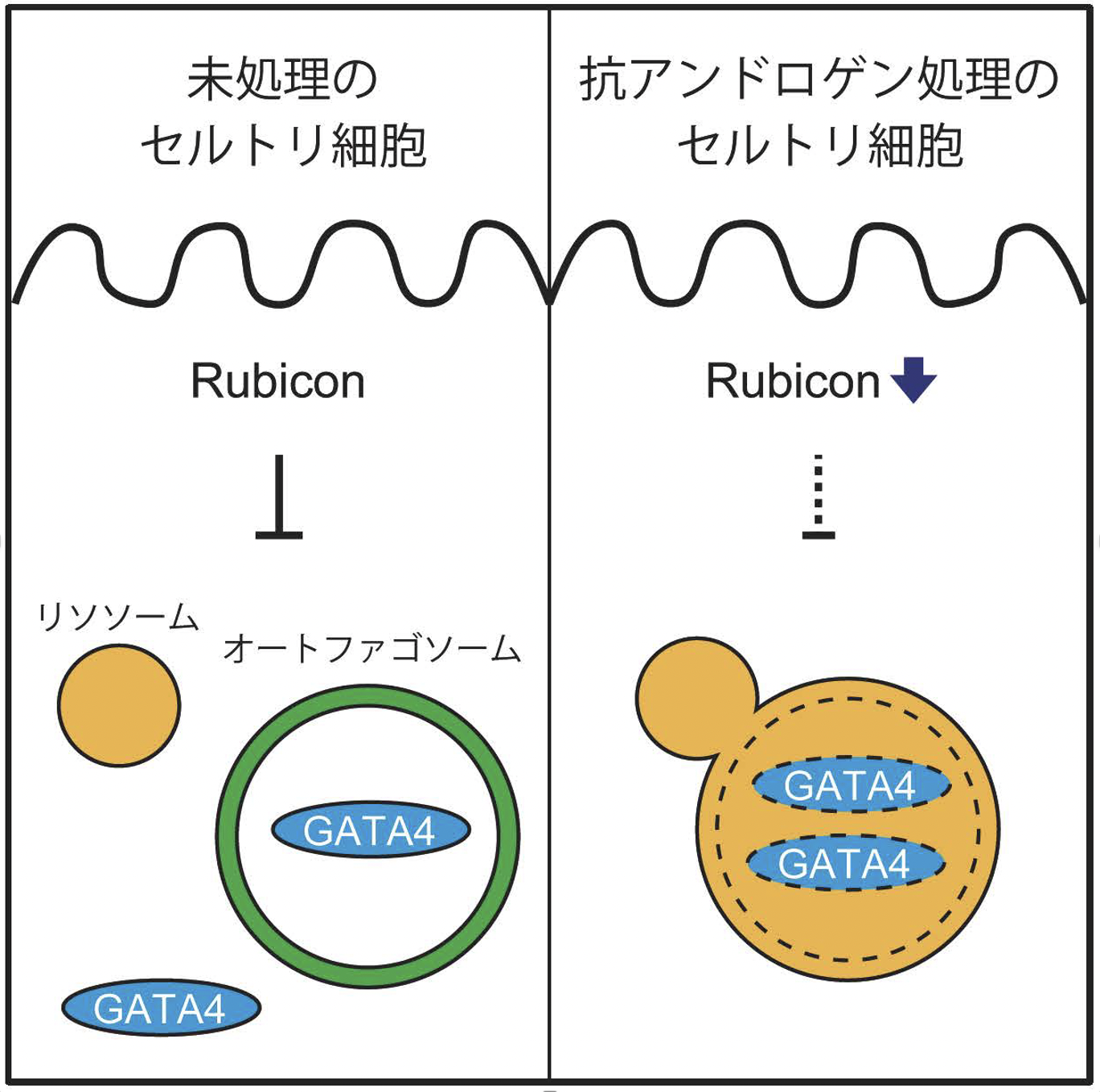
図3. セルトリ細胞におけるGATA4の制御機構
未処理のセルトリ細胞では、RubiconがGATA4のオートファジー分解を負に制御している(左図)。抗アンドロゲン薬を処理したセルトリ細胞ではRubiconが減少し、リソソームとオートファゴソームが融合し、GATA4のオートファジー分解が進行する(右図)。
本研究成果が社会に与える影響(本研究成果の意義)
深刻な少子化が起きている日本では、晩婚化の進行に伴う不妊が大きな社会的問題となっています。不妊の約半数は男性に原因があり、さらに、男性不妊の約半数は原因不明と考えられています。本研究では、セルトリ細胞での過剰なオートファジーが妊孕性低下の一因となることが明らかになりました。原因不明とされていた男性不妊の一部に、セルトリ細胞でのオートファジー過剰が関わっている可能性があり、今回の発見が男性不妊の診断・治療に役立てられることが期待されます。
特記事項
本研究成果は、2021年8月6日(金)午前3時(日本時間)に米国科学誌「PLOS Genetics」(オンライン)に掲載されました。
【タイトル】 “Rubicon prevents autophagic degradation of GATA4 to promote Sertoli cell function”
【著者名】
Tadashi Yamamuro1, Shuhei Nakamura1, 2, 3*, Yu Yamano2, Tsutomu Endo4, Kyosuke Yanagawa1, 5, Ayaka Tokumura1, Takafumi Matsumura4, Kiyonori Kobayashi4, Hideto Mori6, 7, Yusuke Enokidani1, Gota Yoshida1, Hitomi Imoto1, 2, Tsuyoshi Kawabata1, 2, 8, Maho Hamasaki1, 2, Akiko Kuma1, 2, Sohei Kuribayashi9, Kentaro Takezawa9, Yuki Okada10, Manabu Ozawa11, Shinichiro Fukuhara9, Takashi Shinohara12, Masahito Ikawa4, 11, and Tamotsu Yoshimori1, 2, 13*(*共同責任著者)
【所属】
1 大阪大学 大学院医学系研究科 遺伝学
2 大阪大学 大学院生命機能研究科 細胞内膜動態学
3 大阪大学 高等共創研究院
4 大阪大学 微生物病研究所
5 大阪大学 大学院医学系研究科 循環器内科学
6 慶應義塾大学 先端生命科学研究所
7 慶應義塾大学 大学院政策・メディア研究科
8 長崎大学 原爆後障害医療研究所
9 大阪大学 大学院医学系研究科 泌尿器科学
10 東京大学 定量生命科学研究所
11 東京大学 医科学研究所
12 京都大学 大学院医学研究科 分子遺伝学
13 大阪大学 先導的学際研究機構 生命医科学融合フロンティア研究部門
なお、本研究は日本医療研究開発機構(AMED) 「老化メカニズムの解明・制御プロジェクト(分担課題名:オートファジーによる寿命延長機構)」(吉森保)、革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域(研究開発課題名:生殖腺によるオートファジー活性化を介した寿命制御機構の解明)(中村修平)、日本学術振興会科学研究費補助金によりサポートされる研究の一環として行われ、大阪大学大学院医学系研究科 泌尿器科学、東京大学 定量生命科学研究所、医科学研究所、京都大学 大学院医学系研究科 分子遺伝学との共同研究で行われました。
用語説明
- セルトリ細胞
生殖細胞(将来精子になる細胞)以外の細胞を体細胞といい、セルトリ細胞は精巣における大型の体細胞である。生殖細胞を物理的に支えるだけでなく、様々なサイトカインを分泌して生殖細胞に与えている。これらの機能を介して、生殖細胞の維持・分化に寄与している。また、精巣血液関門を形作り、血液中の有害物質から生殖細胞を守る働きもある。
- オートファジー
細胞内の分解系であり、不要物を分解して除去することで、細胞を健康に保っている。オートファジーが誘導されると、隔離膜という扁平な膜構造が出現し、細胞にとって不要な構造物を包み込みながらオートファゴソームを形成する。これが消化酵素を含むリソソームと融合することで中身を分解・除去している。オートファジーはがんや神経変性疾患など、多様な疾患の発症を抑制していることが知られている。
- Rubicon (Run domain Beclin-1 interacting and cysteine-rich containing protein)
本研究グループの吉森教授らが2009年にオートファジーの抑制因子として報告したタンパク質である。PI3Kという酵素複合体に結合し、オートファゴソームとリソソームの融合を負に制御している。肝臓や神経系でRubiconを抑制するとオートファジー活性が高まり、脂肪肝や神経変性疾患が改善することが分かっている。
- 妊孕性
生殖機能とほぼ同義とされ、雌雄における妊娠に必要な臓器、配偶子、機能をいう。
- 転写因子
特殊なタンパク質の一群。複数種類のタンパク質の合成を制御することで、個々の細胞にとって必要な機能を維持している。
