世界初!ATP合成酵素から変化した滑走の ツインモーターの構造を明らかに
研究成果のポイント
- 最小細菌である「マイコプラズマ・モービレ」の分子モーターの構造を解明。
- 生命に欠かせないATP合成酵素から進化した全く新しい構造を発見。
- 細胞やタンパク質の進化について新たな理解に繋がる可能性を示唆。
概要
大阪市立大学大学院 理学研究科の宮田 真人(みやた まこと)教授は、大阪大学日本電子YOKOGUSHI協働研究所の難波 啓一(なんば けいいち)特任教授、大阪大学蛋白質研究所の加藤 貴之(かとう たかゆき)教授、金沢大学ナノ生命科学研究所の古寺 哲幸(こでら のりゆき)教授、安藤 敏夫(あんどう としお)特任教授の研究チームと共同で、最小の細菌である「マイコプラズマ・モービレ」が滑走するための分子モーターの構造を世界で初めて明らかにしました。この発見は、細胞やタンパク質の進化に対する理解に一石を投じるもので、ナノスケールのデバイスや医薬品を開発するための基盤になることが期待されます。
マイコプラズマは、菌体の片側に小さな突起“滑走装置”を形成し、この突起で宿主組織の表面にはりつき、はりついたまま“滑走運動”を行います。この運動はマイコプラズマの限られた種にのみ見られる特殊なもので、運動のエネルギーはATP加水分解により供給されます。この運動を担う分子モーターがほとんどの生物に存在するATP合成酵素から進化したことが遺伝情報を基に示唆されていましたが、構造観察に基づいた直接の証拠はありませんでした。今回、生化学的な手法、電子顕微鏡、そして最先端技術である高速原子間力顕微鏡(高速AFM)を用いることで、滑走の分子モーターの構造をナノメートルレベルで明らかにすることに成功しました。
本研究成果は、2021年7月20日19時(日本時間)に、米国微生物学会オンライン誌である『mBio』に掲載されました。
研究の内容
本研究では、マイコプラズマ滑走のための分子モーターを細胞から取り出し、電子顕微鏡と高速AFMを用いて、その構造をナノメートルレベルで明らかにしました。驚いたことにそれは、2つのATP合成酵素が円筒状の複雑な構造を介してペアを形成し、さらに縦方向につながって鎖になったものでした(下図右)。これまでに似たような構造は全く見つかっていません。この構造は、マイコプラズマ滑走運動の分子メカニズムを原子レベルで解き明かす大きなヒントを与えるだけではなく、マイコプラズマの滑走モーターがATP合成酵素に由来することを示しています。また、ATP合成酵素が運動という本来とは全くかけ離れた役割を担うように進化したことも明らかになりました。
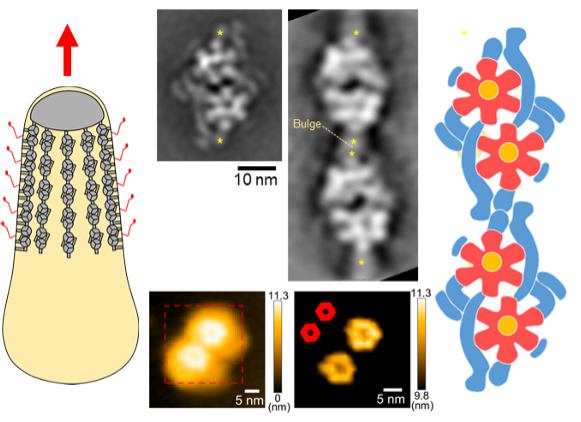
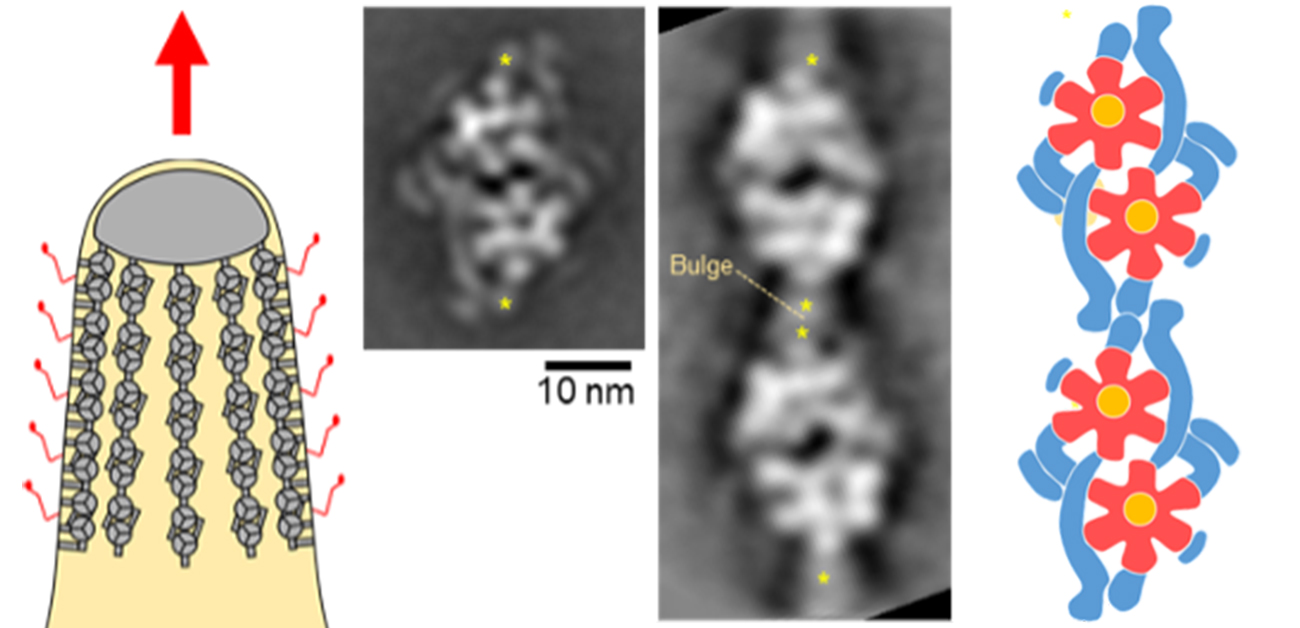
図 滑走の分子モーター
(左)マイコプラズマ細胞の模式図。赤矢印の方向に滑走する。分子モーターは細胞膜の直下に存在し、外側の赤い線で表されたあしを動かす。(中央上)電子顕微鏡像。(中央下)高速AFM像。(右)分子モーターの模式図。赤と黄で表された花の様な部分がATP合成酵素に似ている部分。青で表された円筒状の構造でペアと鎖が形成されている。
©大阪市立大学 宮田真人
今後の展開
単離した分子モーターをクライオ電子顕微鏡法で解析することで、原子レベルの構造を明らかにして、ATP加水分解のエネルギーがどのように滑走運動の動きに変換されるかを構造から読み解いていきます。また、単離したモーターのATP加水分解反応における実際の動きを高速AFMにより明らかにします。
滑走の構造とメカニズムの詳細を明らかにすることで、運動能の起源と動作原理に迫ることができ、ナノスケールのデバイスや医薬品を開発するための基盤になることが期待されます。
特記事項
雑誌名:mBio(IF=7.9)
論文名:Chained structure of dimeric F1-like ATPase in Mycoplasma mobile gliding machinery
著者:Toyonaga T, Kato T, Kawamoto A, Kodera N, Hamaguchi T, Tahara YO, Ando T, Namba K, Miyata M.
URL:https://doi.org/10.1128/mBio.01414-21
参考動画: https://www.youtube.com/watch?v=-LRdogB3U8s (マイコプラズマ・モービレの滑走の様子)
本研究は、下記の計画研究の一部として行われました。
- 科研費・新学術領域「運動超分子マシナリーが織りなす調和と多様性」
- 科研費・基盤研究(A)「病原細菌、Mollicutes綱における3種の運動メカニズム」
- 科研費・基盤研究(B)「マイコプラズマ滑走運動装置の構造と動き」
- CREST研究・「合成細菌JCVI syn3.0B とゲノム操作を用いた細胞進化モデルの構築」
https://www.jst.go.jp/kisoken/crest/project/1111100/1111100_2019.html - 2018年度大阪市立大学戦略的研究経費(重点研究)
- 医用薬物研究奨励富岳基金 (研究代表:宮田真人)
- 科研費・特別推進研究「クライオ電子顕微鏡による生体分子モーターの立体構造と機能の解明」
- 文部科学省 創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)
- 日本医療研究開発機構「医療研究開発革新基盤創成事業」
- 日本電子YOKOGUSHI協働研究所 (研究代表:難波啓一、大阪大学特任教授)
用語説明
- ATP
ミトコンドリア内で生成される生体内のエネルギーの貯蔵・供給・運搬を仲介している重要な物質。
- 高速原子間力顕微鏡(高速AFM)
原子間力顕微鏡(Atomic Force Microscopy: AFM)は、探針と試料の間に働く原子間力を元に、分子の形状をナノメートル(10-9 m)程度の高い空間分解能で可視化する顕微鏡。高速AFMは、金沢大学の安藤敏夫特任教授のグループによって開発された超高速で観察できるAFMで、サブ秒(~0.1秒)という時間分解能で、水溶液中にあるタンパク質などの生体分子や細胞の形状や動態をその周囲の環境を含めて観察することができる。
