細胞の生存に不可欠な細胞接着の分子基盤を解明
ES・iPS 細胞など幹細胞培養用基質の研究開発の加速に期待
研究成果のポイント
・基底膜の主成分である細胞接着蛋白質ラミニン(laminin)と細胞表面受容体インテグリン(integrin)との相互作用の分子メカニズムを明らかにした
・ラミニンを介する基底膜への接着は動物の胚発生や様々な臓器の恒常性維持に極めて重要なプロセスだが、中心的な役割を担うインテグリンによるラミニンの認識機構の分子メカニズムは不明だった
・今回の成果は、ラミニンをベースにした次世代の細胞培養用基質の研究開発を加速させるための情報基盤を提供する
概要
大阪大学蛋白質研究所の関口清俊寄附研究部門教授の研究グループは、同研究所の高木淳一教授のグループと共同して、インテグリン によるラミニン認識機構の分子メカニズムを明らかにしました。
ラミニンは基底膜 の形成、および細胞接着活性の付与に重要な役割を果たしています。細胞表面のインテグリンを介したラミニンの細胞接着活性は、他の細胞接着蛋白質に比べて極めて強く、細胞培養用基質として近年注目されています。しかし、インテグリンによるラミニンの認識機構は明らかになっていませんでした。
今回、関口教授らの研究グループは、高木教授らの研究グループと共同して、ラミニンのインテグリン結合領域のX線結晶構造解析に成功しました。また、取得した構造情報に基づいた生化学的手法による詳細な解析に取り組み、ラミニン-インテグリン間相互作用の基本メカニズムを明らかにしました。この成果はラミニン-インテグリン間相互作用の理解を分子レベルで深め、再生医療を支える次世代細胞培養用基質の創出につながることが期待されます。
本研究成果は、2017年9月2日(土)午前3時(日本時間)に米国科学誌「Science Advances」(オンライン)に掲載されました。
研究の背景
動物の体は“上皮”と呼ばれる細胞のシートを基本構造としてつくられています。上皮細胞シートは直下の“基底膜”によって裏打ちされ、結合組織から隔てられています。膵臓(インスリン産生)や肺(ガス交換)など、各臓器が持つ主な機能は上皮細胞が担っており、基底膜はこれら上皮細胞の恒常性の維持に不可欠です。基底膜への細胞接着は、基底膜の主成分であるラミニンと細胞表面受容体インテグリンとの相互作用に大きく依存しています。ラミニンは3つの鎖(α鎖、β鎖、γ鎖)から構成される巨大な細胞外マトリックス蛋白質 です。他の細胞外マトリックス蛋白質に比べ、ラミニンは極めて高いインテグリン結合活性を有します。ラミニンを接着基質として用いるES・iPS細胞の培養方法はこの特性を利用したものであり、国内にとどまらず、世界各国の再生医療を支える基盤技術として普及しています。
ラミニンがインテグリン結合活性を発揮するためには、α鎖C末端側の3つの球状ドメイン(LG1–3)とγ鎖C末端領域(γ-tail)の両方が必要です。しかし、これらの要素がどのようにしてラミニンのインテグリン結合活性に寄与するのか、これまで明らかになっていませんでした。
研究の内容
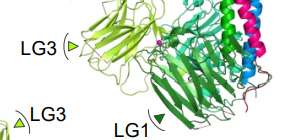
今回、本研究グループはラミニンのインテグリン結合領域の立体構造解析に成功しました (図1) 。ラミニンのインテグリン結合領域は、“クローバーの葉”のように会合したα鎖LG1–3を底面とする“おたま”様の構造を呈し、柔軟性に富んだγ-tailを底面側にぶら下げていました。また、ラミニン-インテグリン複合体を電子顕微鏡で観察すると、インテグリンはγ-tailを含むラミニン底面に結合しました (図2) 。
また、ラミニン-インテグリン複合体でのγ-tailの空間配置を解析したところ、γ-tailはインテグリン頭部が作る結合ポケットに捕捉されていました。そこで、γ-tail由来の合成ペプチドでインテグリン頭部の結合ポケットにフタをすると、ラミニンとインテグリンとの結合が有意に阻害されました。さらに、ラミニンはγ-tailを欠損するとインテグリンへの結合効率が1/400以下に低下しました。以上の結果より、γ-tailとインテグリンとの結合がラミニン-インテグリン間相互作用の中核を担うことが明らかになりました。
図1 ラミニンのインテグリン結合領域の立体構造。インテグリン結合活性に必須のγ-tailはラミニンの底面側に位置するが、その柔軟さから構造が定まっていない(右)。
図2 ラミニン-インテグリン複合体の電子顕微鏡写真(左)。インテグリンはラミニンの底面に結合する。(右:概略図)
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、ラミニンの生理機能の本質であるインテグリンとの相互作用の分子メカニズムが明らかになりました。現在、ラミニンはES・iPS細胞のための培養基質として再生医療分野で広く使われています。ラミニンを利用した培養基質のさらなる発展には分子レベルでの理解が不可欠です。本研究によって得られた知見は、今後、より優れた機能を持つ新たなラミニン基質の設計やラミニンのインテグリン結合活性を再現した低分子化物の創出につながると期待されます。
特記事項
本研究成果は、2017年9月2日(土)午前3時(日本時間)に米国科学誌「Science Advances」(オンライン)に掲載されました。
タイトル:“Mechanistic basis for the recognition of laminin-511 by α6β1 integrin”
著者名:Mamoru Takizawa 1* , Takao Arimori 2 , Yukimasa Taniguchi 1 , Yu Kitago 2 , Erika Yamashita 1 , Junichi Takagi 2 , Kiyotoshi Sekiguchi 1**
* 筆頭著者
** 責任著者
1 大阪大学蛋白質研究所マトリクソーム科学(ニッピ)寄付研究部門
2 大阪大学蛋白質研究所分子創製学研究室
研究者のコメント
我々のからだを作る細胞は、無数の蛋白質間相互作用によってその挙動が制御されています。ラミニン-インテグリン間相互作用もそのひとつであり、細胞の生存にとって不可欠な“細胞接着”という挙動を支えています。生命活動の原動力である蛋白質間相互作用の分子メカニズムを紐解き、その情報を利用して、新たなメカニズムの発見や革新的な基材の開発につなげることを目標に研究に取り組んでいます。本研究成果はその第一歩です。
参考URL
蛋白質研究所 マトリクソーム科学(ニッピ)寄附研究部門
http://www.protein.osaka-u.ac.jp/matrixome/index.html
蛋白質研究所 分子創製学研究室
http://www.protein.osaka-u.ac.jp/rcsfp/synthesis/index.html
用語説明
- 基底膜
ラミニン、ニドゲン、IV型コラーゲン、パールカンを主成分とするシート状の構造物。細胞間接着蛋白質と同様に、多細胞動物の基本構造の構築に不可欠であり、細胞の遊走・増殖に必要な足場を提供する。
- インテグリン
α鎖、β鎖からなるヘテロ2量体の細胞表面受容体。ラミニンのほか、コラーゲンやフィブロネクチンといった細胞外マトリックス蛋白質を認識する。
- 細胞外マトリックス蛋白質
細胞の外に存在し、その足場となる不溶性の蛋白質。コラーゲンやiPS細胞の培養に用いられるラミニンなどが知られている。
