細菌べん毛モーターの基礎となるMSリングの構造を解明
1種類の分子34個が集合して織りなす複雑なシンメトリー構造
研究成果のポイント
概要
大阪大学大学院理学研究科の今田勝巳教授、竹川宜宏助教、名古屋大学大学院理学研究科の本間道夫教授、大阪大学大学院生命機能研究科の難波啓一特任教授らの共同研究グループは、細菌のべん毛モーターの基礎となる蛋白質複合体『MSリング』の構造と集合のしくみを明らかにしました。
べん毛の基礎部分には、MSリングと呼ばれる巨大で複雑な形の構造体があります。約30年前にMSリングがFliFという一種類の蛋白質が多数集合してできていることがわかりました。しかし、MSリングの形はあまりに複雑で、FliFがどのように集合してMSリングができているのか、ずっと謎でした。
今回、共同研究グループは、クライオ電子顕微鏡を用いた観察とX線結晶構造解析を組み合わせることで、MSリング内でのFliFの集合様式を原子レベルで解明しました。これにより、複雑な生体分子モーターの機構解明はもちろんのこと、自然界に多く存在するリング状の分子複合体の進化の解明、将来の人工分子装置や分子デバイスの設計に役立てることが期待されます。
本研究成果は、米国科学誌「mBio」に2021年3月3日(日本時間)にオンライン公開されました。
研究の背景

細菌は、べん毛とよばれるらせん状の線維を回して水中を泳ぎ、危険を回避したり住みやすい環境へ移動したりします。べん毛の根本には蛋白質でできた直径約45ナノメートルの極小の回転モーターがあります。このモーターは十種類以上の蛋白質が合計数百個集まってできていて、F1レース用のエンジンに匹敵する毎分約20,000回転という超高速で回転し、エネルギー変換効率は100%に近いとても高性能なモーターです。
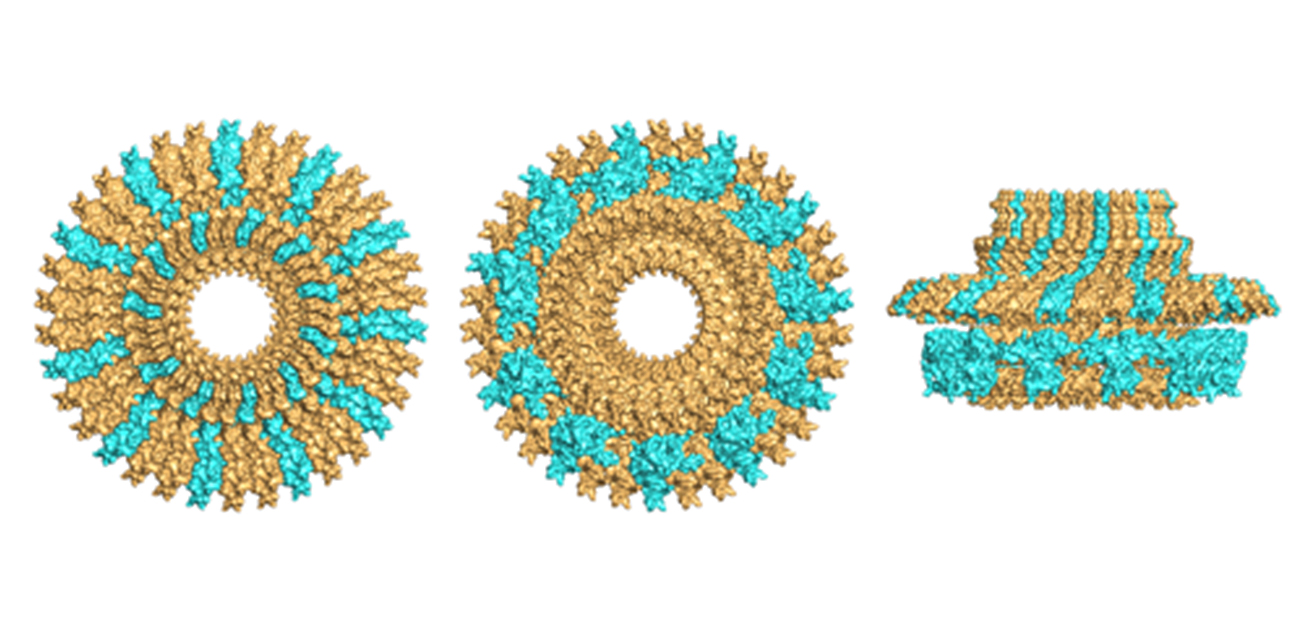
MSリングはFliFという蛋白質が数十個集合した環状の構造体で、べん毛構築最初期に形成され、べん毛の基礎部分となります。2つのリングが上下に重なった形をしていて、各リングの内径が異なっているのが大きな特徴です。MSリングの構造はこれまでにも主に電子顕微鏡観察を用いて解析されてきました。しかし、MSリングが何個のFliFでできているのか、異なる2種類の内径がどのように生み出されるのか不明でした。
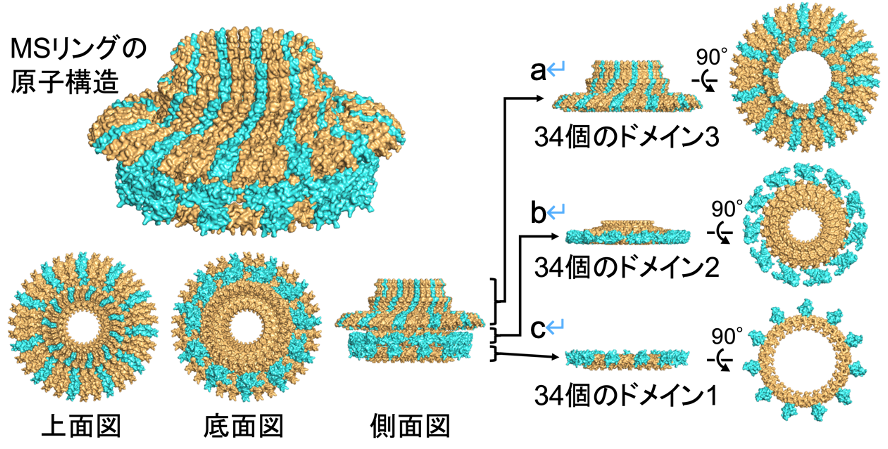
共同研究グループは、精製したMSリングのクライオ電子顕微鏡-単粒子解析と、精製したFliF断片のX線結晶構造解析を組み合わせて、本来の機能する状態のMSリングの原子レベルの構造モデルを構築することに成功しました。その結果、MSリングは2種類の異なる構造を持つ34個のFliFが規則的に折り畳まって作られることが明らかになりました。
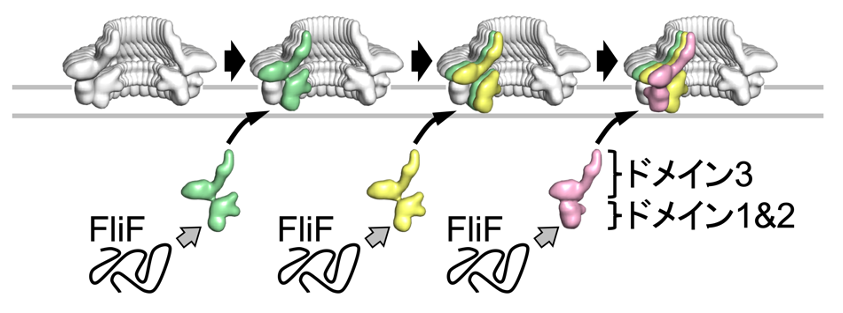
MSリング中の各FliF分子は3つのドメイン(ドメイン1、ドメイン2、ドメイン3)からなり、各ドメインは柔軟なリンカーで繋がれています。MSリングは34個のFliFでできているので、MSリング内にドメイン1,2,3がそれぞれ34個存在することになります。34個のドメイン3はMSリングの上方で大きな直径の環状構造を形成します(上図aの領域)。一方、34個のドメイン2のうち、23個はMSリングの下方で小さな直径の環状構造を形成し(上図bのオレンジ色の領域)、残りの11個はその外側にほぼ等間隔で並ぶ(上図bの水色の領域)ことで、ドメイン2は歯が11個ある歯車のような構造を形成します。ドメイン1はそれぞれのドメイン2の下方に配置されます(上図cの領域)。すなわち、一種類の蛋白質FliFが複数の構造状態(34回、23回、11回のシンメトリー)を取ることが、MSリングの形成のために必須であることを、世界で初めて提唱しました。
本研究成果が社会に与える影響(本研究成果の意義)
べん毛による細菌の運動性は細菌の感染や病原性に密接に関係しています。MSリングはべん毛形成の基礎であり、モーターの中央に位置してべん毛構造を支える基盤となる構造体です。MSリングの形成や機能を阻害する物質は新規抗生物質の候補になります。本研究の結果により新規抗生物質の開発の推進が期待されます。
MSリングのように環状の蛋白質複合体は、細胞膜に穴を開けたり、あるいは内側に別の蛋白質複合体を抱え込むことで不安定な構造を安定化したりします。自然界にはこのような構造体が数多く存在し、様々な機能を担っています。しかし、一種類の蛋白質が一つの複合体内で異なる複数のシンメトリーの環状構造を取るという例はこれまでにありません。生物の進化において、FliFという一種類の蛋白質が様々な種類の環状形成蛋白質へと変化したことに関する新たな解釈が生み出されました。今回のMSリングの構造の解明は自然界に多く存在するリング状の分子複合体の進化の解明につながるとともに、複雑で未だ解明されていない環状蛋白質複合体も同様な原理で形成されているかもしれません。また、1種類の分子から複雑な構造体を形成するしくみは、将来の人工分子装置や分子デバイスの設計に役立つ貴重な情報となると考えられます。
特記事項
本研究成果は、2021年3月3日(日本時間)に米国科学誌「mBio」(オンライン)に掲載されました。
タイトル:“Two distinct conformations in 34 FliF subunits generate three different symmetries within the flagellar MS-ring”
著者名:Norihiro Takekawa1, Akihiro Kawamoto2,3, Mayuko Sakuma4, Takayuki Kato2,3, Seiji Kojima4, Miki Kinoshita2, Tohru Minamino2, Keiichi Namba2,5,6, Michio Homma4 and Katsumi Imada1
所属:
1大阪大学大学院理学研究科
2大阪大学大学院生命機能研究科
3大阪大学蛋白質研究所
4名古屋大学大学院理学研究科
5理化学研究所放射光科学研究センター
6日本電子YOKOGUSHI協働研究所
なお、本研究は、科学研究費補助金基盤研究(A)、基盤研究(B)、基盤研究(C)、若手研究、特別研究員奨励費、特別推進研究、および新学術領域研究(研究領域提案型)による支援のもとに行われました。また、本研究は大阪大学、名古屋大学が共同で行ったものです。
参考URL
SDGs目標

用語説明
- MSリング
べん毛モーターを構成する構造体の一つ。べん毛形成の際の土台の役割を担う。一種類の蛋白質FliFが34個集まることで形成される。
- クライオ電子顕微鏡
観察試料ステージを液体窒素や液体ヘリウムによって冷却することができる電子顕微鏡。主にタンパク質など生体試料の構造解析に用いられる。試料を液体エタンで急速に凍結するため、生体分子を機能状態の構造として直接観察できる。
- X線結晶構造解析
結晶にX線を当てたときに生じるパターンから結晶中の分子の構造を調べる実験手法。蛋白質のような生体試料を結晶化することで、原子分解能での構造解析ができる。
- ドメイン
蛋白質を構成するペプチド鎖がコンパクトに折畳まって塊のようになった部分のこと。
