世界初!生物モーターのパワーアップアイテム 細菌べん毛モーターの出力強化蛋白質FliLのしくみを解明
哺乳類から細菌まで共通の構造
研究成果のポイント
・病原菌などの細菌が粘液中や宿主細胞表面など粘性の高い環境を移動するにはFliL という膜蛋白質が必要。
・FliLは細菌べん毛モーターの出力を強化すると言われていたが、そのしくみは不明だった。
・世界で初めてFliLの立体構造を解明し、FliLは哺乳類の神経細胞にも存在するストマチン様蛋白質 という蛋白質グループと共通の構造を持つことが分かり、全ての生物において同じような機構で多様な膜蛋白質が制御される可能性を発見。
・べん毛モーターの作動原理の解明により、これまでにない超高効率微小モーターや、一般的に検出が難しいとされる機械刺激に対するナノセンサーの開発への応用に期待。
概要
大阪大学大学院理学研究科の今田勝巳教授、竹川宜宏日本学術振興会特別研究員、名古屋大学大学院理学研究科の本間道夫教授の共同研究グループは、細菌のべん毛モーターをパワーアップする蛋白質、FliLの構造と機能のしくみを世界で初めて明らかにしました。 (図1)
細菌はべん毛と呼ばれるらせん状の繊維を、蛋白質でできた小さなモーターを使ってスクリューのように回して泳ぎます。べん毛モーターには電気モーターと同様に回転子 と固定子 があり、両者の相互作用で力が発生します。粘性のある液体中を泳ぐなど負荷が高くなるとべん毛モーターは出力を上げますが、このときFliL蛋白質が必要です。遺伝子変異でFliLを失った細菌は高粘性下での運動能を失います。細菌は、ヒトなどに感染するときに粘液中や宿主の細胞表面など粘性が高い場所を移動するため、FliLを失うと感染力も失われます。しかし、FliLがモーターの高出力化にどのように寄与するのか、長い間謎でした。今回、共同研究グループは、X線結晶構造解析 によりFliLの立体構造を世界で初めて解明しました。その結果、FliLは10個の分子からなるリング状の複合体を形成すること、哺乳類の神経や赤血球などにも存在するストマチン様蛋白質と共通の構造を持つことが明らかになりました (図2) 。ストマチン様蛋白質は外部刺激を受け取り、イオンチャネルなどの多様な膜蛋白質の活性を制御することが知られています。しかし、ストマチン様蛋白質が具体的にどのような分子機構により機能を発揮するかに関してはほとんど分かっていません。本研究では、FliLが固定子の周りを取り囲むように複合体を形成し、FliLリングの内壁が固定子と相互作用して固定子を活性化することを明らかにしました (図1) 。本研究から得られた知見は、細菌モーターの出力強化のしくみだけでなく、上述のストマチン様蛋白質のような哺乳類や植物を含めた全ての生物における膜蛋白質の活性制御の共通機構を明らかにすることに繋がります。
本研究成果は、2019年3月19日(火)19時(日本時間)、米国科学誌「mBio」にオンライン公開されました。
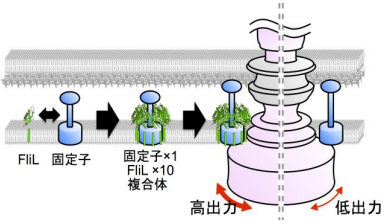
図1 FliLの機能の仕組み
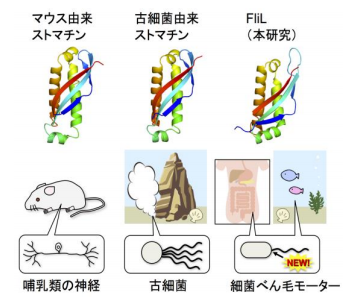
図2 様々な生物由来のストマチン様蛋白質の構造
研究の背景
多くの細菌は、べん毛とよばれるらせん状の線維を細胞の表面から生やし、それをスクリューのように回転させることで動きます (図3) 。べん毛の根元には、直径約45ナノメートルの蛋白質でできた極小のモーターが存在します。このモーターは毎秒約300~1,000回転という高速で回転します。べん毛モーターのエネルギー源は細胞の外から中に流れるイオン(H + ,Na + など)の流れで、極めて高いエネルギー効率で作動します。べん毛モーターは回転子と固定子で構成され、固定子内をイオンが流れると、固定子と回転子との間の相互作用が変化し、回転力が生じます。
細菌は、感染するときに粘液中や宿主の細胞表面など粘性が高い場所を移動します。このとき、べん毛モーターは水中を移動するときよりも高い出力を出す必要がありますが、出力を上げるために必要な因子がFliL蛋白質です。FliLが欠損すると、多くの細菌は高粘性下での運動能を失い、感染できなくなります。また、FliLは周囲の粘性を感知する機能も持ちます。しかし、FliLがこのような機能を発揮するメカニズムはほとんど分かっていませんでした。
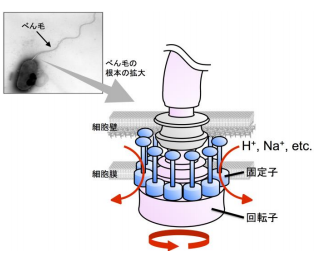
図3 細菌のべん毛モーターの模式図
研究の内容
共同研究グループは、海洋性細菌Vibrio alginolyticusのFliL蛋白質が機能する分子機構を解明しました。
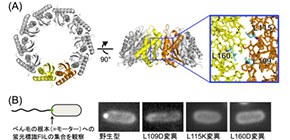
FliLの機能に必須の細胞壁側部分(FliL C )に着目し、大型放射光施設SPring-8を用いたX線結晶構造解析により、FliL C の立体構造を明らかにしました。その結果、10個のFliL分子が集まって一つのリング状の複合体を形成することが分かりました (図4) 。そしてFliLリングが膜蛋白質である固定子と複合体を形成して一緒にべん毛モーターに組み込まれること、またFliLリングの内壁が固定子と相互作用して固定子の活性を制御することを明らかにしました。さらに興味深いことに、FliLは哺乳類の神経細胞や赤血球の中などにも存在するストマチン様蛋白質と共通の構造を持つことがわかりました (図2) 。ストマチン様蛋白質は細胞膜上で機械刺激や酸刺激などのさまざまな情報を受け取り、多様な膜蛋白質の働きを制御することが知られています。今回、FliLが新しいストマチン様蛋白質であることを発見し、ストマチン様蛋白質が膜蛋白質を制御する具体的な分子機構を世界で初めて提唱しました。

図4 FliL C のX線結晶構造と変異導入時のFliLの細胞内局在観察
本研究成果が社会に与える影響(本研究成果の意義)
べん毛モーターは、エネルギー変換効率がほぼ100%の高性能な回転ナノマシンであると同時に、周囲の粘性や物理抵抗を感知するナノセンサーでもあります。その作動原理の解明は、これまでにない超高効率微小モーターや、一般的に検出が難しいとされる機械刺激に対するナノセンサーの開発に繋がります。
また今回、細菌のべん毛の中の現象が、動物の神経などと共通の機構を使っていることを示す結果が世界で初めて得られました。本研究から得られた知見は、べん毛モーターの作動原理の解明のみならず、全ての生物に共通した、ストマチン様蛋白質による膜蛋白質の活性制御の機構の解明に繋がります。
特記事項
本研究成果は、2019年3月19日(火)19時(日本時間)に米国科学誌「mBio」(オンライン)に掲載されました。
タイトル:“Structure of Vibrio FliL, a new stomatin-like protein that assists the bacterial flagellar motor function”
著者名:Norihiro Takekawa 1 , Miyu Isumi 1 , Hiroyuki Terashima 1 , Shiwei Zhu 2,3 , Yuuki Nishino 2 , Mayuko Sakuma 2,4 , Seiji Kojima 2 , Michio Homma 2 , Katsumi Imada 1
所属
1 大阪大学大学院理学研究科
2 名古屋大学大学院理学研究科
3 Yale School of Medicine, Yale University
4 名古屋大学アイソトープ総合センター
なお、本研究は、科学研究費補助金基盤研究(A)、特別研究員奨励費、挑戦的研究(萌芽)および新学術領域研究(研究領域提案型)による支援のもとに行われました。また、本研究は大阪大学、名古屋大学が共同で行ったものです。
参考URL
大阪大学 大学院理学研究科 高分子科学専攻 高分子構造科学研究室
http://www.chem.sci.osaka-u.ac.jp/lab/okuyama/index.html
用語説明
- FliL
べん毛モーターを構成する蛋白質の一つ。多くの細菌で高粘性下でのモーターの高出力回転に必須。
- ストマチン様蛋白質
動物や植物などの真核生物から細菌などの原核生物まで保存された蛋白質ファミリーの一種。SPFHファミリー蛋白質とも呼ばれる。イオンチャネル様蛋白質、膜貫通型の蛋白質分解酵素、G蛋白質などの多様な膜蛋白質と相互作用し、その活性を制御する。その具体的な機構は明らかになっていない。
- 回転子
べん毛モーターにおいて回転する部分。中心軸とそれを取り囲むいくつかのリングからなる。細菌の細胞膜と細胞壁を貫通して存在し、べん毛繊維につながる。
- 固定子
べん毛モーターにおいて固定された部分。それ自身は回転せず、回転のためのエネルギー変換を担う。イオンチャネル様蛋白質複合体の一種で、固定子内をイオンが流れると、回転子との相互作用が変化して回転力が発生する。
- X線結晶構造解析
結晶にX線を当てたときに生じるパターンから結晶中の分子の構造を調べる実験手法。
