難治性がんをアルファ線で内部から攻撃
がん細胞型アミノ酸トランスポーターを標的とする放射線療法
研究成果のポイント
- がん細胞型アミノ酸トランスポーターLAT1を対象とした新たなアルファ線治療薬を開発。
- 近年、治療効果が高く、正常細胞への副作用が少ないアルファ線を用いた治療が注目されている。
- LAT1はがんへの栄養分の供給を担っており、がん特異的に大型中性アミノ酸を取り込んでいる。
- 飛程の短い放射線(アルファ線)をがん細胞特異的にデリバリーして細胞内からがん細胞を攻撃。
- 膵臓がんだけでなく、転移のある進行がんにおける画期的な治療法となることが期待される。
概要
大阪大学放射線科学基盤機構の兼田(中島)加珠子特任准教授(常勤)(放射線科学部門)、深瀬浩一教授(理学研究科化学専攻)らの研究チームは、がん細胞型アミノ酸トランスポーターLAT1をターゲットとした新たなアルファ線治療薬(アスタチン標識アルファメチルチロシン: [At-211] AAMT)の開発に成功しました。
LAT1はがん特異的に発現するアミノ酸トランスポーターです。その機能を阻害することで抗腫瘍効果を持つことが知られていましたが、LAT1を標的とする核医学治療薬の開発は進んでいませんでした。
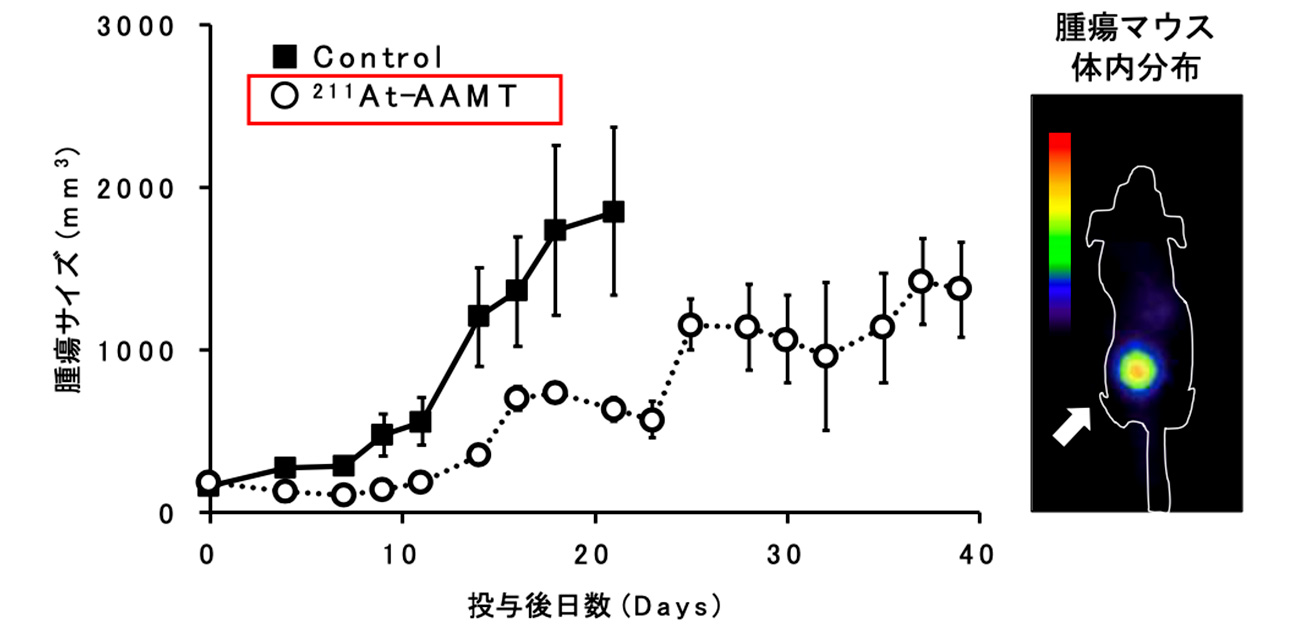
今回、開発した治療薬を膵臓がんのモデルマウスに投与したところ、腫瘍への選択的集積ならびに増殖抑制効果が確認されました(図1)。治療薬はアミノ酸トランスポーターLAT1を介してがん特異的にデリバリーされることが分かりました。つまり、本治療薬はがん細胞に栄養分として取り込まれた後、細胞内部からがんを攻撃することができます。これにより、難治性の膵臓がんのみならず、治療薬のない様々ながんに対する画期的な治療法になることが期待されます。本治療薬は放射線科学基盤機構を中心とした阪大の各部局の連携によるオール阪大チームで開発されました。
本研究成果は、米国科学誌「Cancer Science」に、2020年12月5日(日本時間)に公開されました。
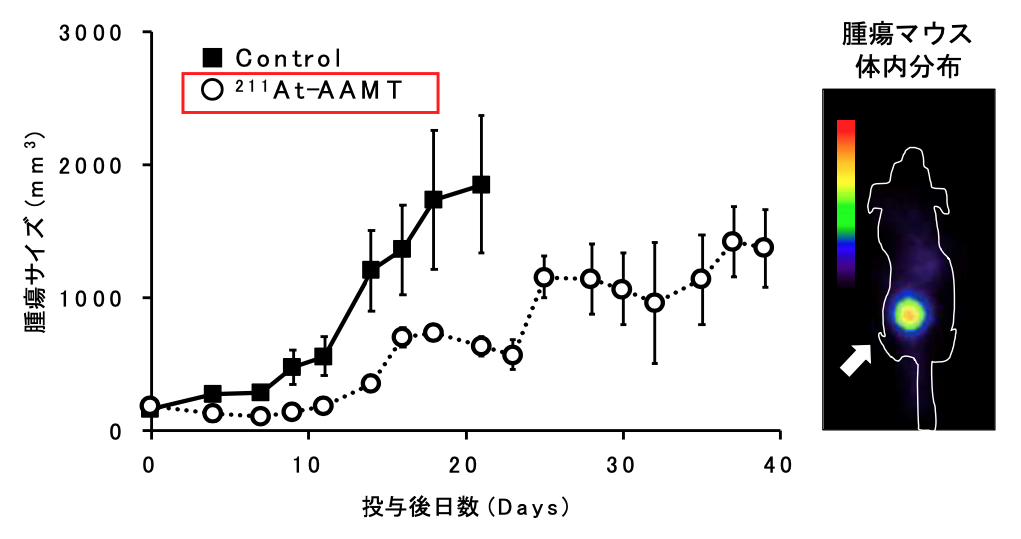
図1 [At-211] AAMTの投与後の増殖抑制効果(左)と膵臓がんモデルマウスにおける[At-211]AAMTの腫瘍(矢印)への集積画像(右)
研究の背景
近年、治療効果が高く、周囲の正常細胞への副作用が少ない放射線であるアルファ線を用いた治療が注目を集めています。これまでのアルファ線治療薬はがん細胞表面に現れる特定の分子をターゲットにしていました。しかし、それらの分子はがん種によって異なることが多く、転移した部位では発現の程度が異なることがありました。LAT1はがん種を問わず発現している上、がんの増悪度と相関していることが知られている優れたがんの治療標的です。また、大阪大学はアルファ線核種であるアスタチンの製造で世界をリードするグループの一つです。
本研究の成果
研究グループでは、大阪大学核物理研究センター、理化学研究所、ならびに短寿命RI供給プラットフォームを利用して、アスタチンの供給を受けました。大型加速器を用いて、荷電粒子をターゲットに照射することでアルファ線放出核種であるアスタチン(At-211、半減期7.2h時間)を製造し、本学放射線科学基盤機構の設備を利用して、分離精製を行いました。その後、LAT1高選択性の芳香族アミノ酸誘導体であるアルファメチルチロシンに結合させることで、がん特異的に集積する注射薬(アスタチン標識アルファメチルチロシン: [At-211] AAMT)の製造に成功しました。
本治療薬を膵臓がんモデルマウスの静脈内に単回投与したところ、腫瘍に選択的に集積し、腫瘍の増殖抑制効果が認められました。がん細胞を特異的にアルファ線で攻撃することにより、治療効果が得られることが確認されました。また、正常細胞にはほとんど取り込まれないことも確認されました(図2)。またメラノーマ(ほくろのがん)肺転移モデルにおいて、単回投与により転移を抑えることができることが示されました(図3)。今後、本治療薬の最適化を行い、将来的には様々ながんの患者さんにとって、有効な治療薬となることを目指しています。
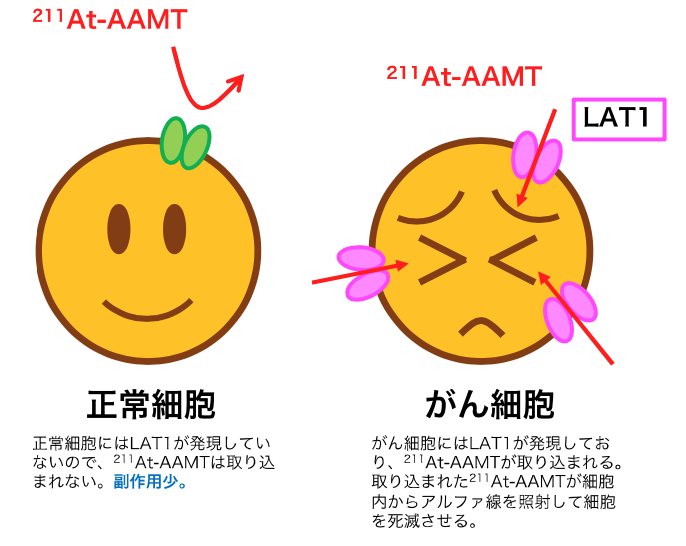
図2 [At-211] AAMTのがん細胞への作用

図3 メラノーマ肺転移モデルにおける[At-211] AAMTの効果。コントロールは転移したほくろのがんのせいで肺が黒くなっている。
本研究成果が社会に与える影響(本研究成果の意義)
アルファ線核医学治療は注射薬による全身治療であり、多発転移のある進行がんにも用いることができます。本研究成果として開発に成功した注射薬であるアスタチン標識アルファメチルチロシン:[At-211] AAMTは、膵臓がんをはじめとする難治性がんにおける、画期的な治療法となることが期待されます。
特記事項
本研究成果は、2020年12月5日(日本時間)に米国科学誌「Cancer Science」(オンライン)に掲載されました。
タイトル:“α-Emitting cancer therapy using 211At-AAMT targeting LAT1”
著者名: 兼田(中島)加珠子1,2*, 張子見2,3 , 真鍋良幸1,2,3, 下山敦史1,2,3, 樺山一哉1,2,3, 渡部直史1,5, 金井好克1,6, 大江一弘1,5, 豊嶋厚史1,2, 白神宜史1,2,5, 吉村崇1,7, 福田光弘1,8, 畑澤順1,5, 中野貴志1,8, 深瀬浩一1,2,3, 篠原厚1,2,4 (*責任著者)
所属:
- 大阪大学 放射線科学基盤機構 放射線科学部門
- 大阪大学 大学院理学研究科附属基礎理学プロジェクト研究センター 医理連携教育研究拠点
- 大阪大学 大学院理学研究科 天然物有機化学
- 大阪大学 大学院理学研究科 放射化学
- 大阪大学 大学院医学系研究科 核医学
- 大阪大学 大学院医学系研究科 生体システム薬理学
- 大阪大学 放射線科学基盤機構 附属ラジオアイソトープ総合センター
- 大阪大学 核物理研究センター
本研究は、日本学術振興会(JSPS)科学研究費助成事業(基盤C: 18K07323、新学術領域研究: 15H05836)ならびに科学技術振興機構(JST)産学共創プラットフォーム共同研究推進プログラム(OPERA: JPMJOP1721)の一環として行われました。また、アスタチンは大阪大学核物理研究センター、短寿命RI供給プラットフォームにより提供されました。
参考URL
放射線科学基盤機構HP
https://www.irs.osaka-u.ac.jp/
用語説明
- がん細胞型アミノ酸トランスポーターLAT1
本学大学院医学系研究科の金井好克教授らによって分子同定されたアミノ酸トランスポーターであり、がん特異的に発現している。がん診断薬の標的分子として、またその阻害薬が抗腫瘍薬として着目されている。
- アルファ線
近年、短い飛程で大きなエネルギーを放出し、治療効果の高い放射線として、治療利用が進んでいる。アルファ線を出す薬をがん病巣に選択的に集めることで、周囲の組織には影響を与えることなく、がんの治療が可能。
- アスタチン標識アルファメチルチロシン: [At-211] AAMT
LAT1に高い選択性を持つアルファメチルチロシンにアルファ線放出核種であるアスタチン(At-211)を標識して作られる治療薬。
