シングルセル質量分析イメージングで がん細胞中の脂質の分布を可視化することに成功
研究成果のポイント
- 1細胞の成分分布を可視化するための、シングルセル質量分析イメージング(SC-MSI)技術を開発。
- 同一の細胞に対して、質量分析イメージングによる細胞内脂質の観察、蛍光顕微鏡による細胞の観察、細胞の表面形状の計測を一度に実施可能にした。
- 細胞内の脂質の分布を可視化でき、異なる種類の細胞を区別できることを示した。
- 治療・診断技術の創成につながる情報の獲得に期待。
概要
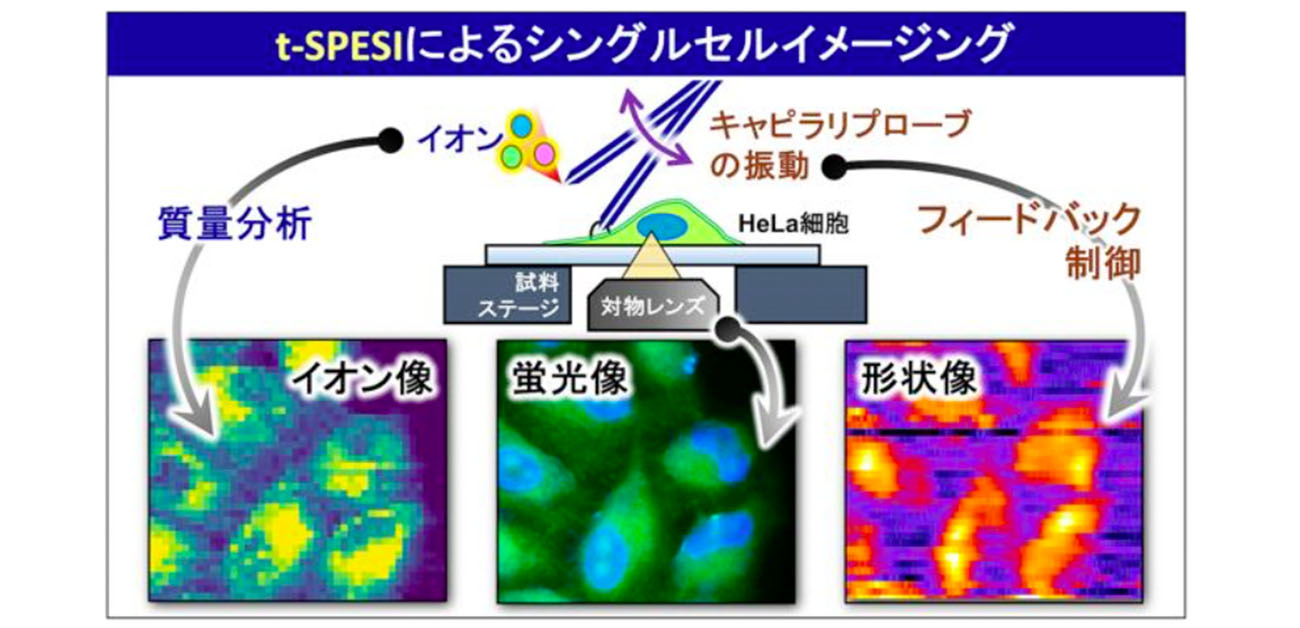
大阪大学大学院理学研究科物理学専攻 大塚洋一准教授、豊田岐聡教授、大阪大学放射線科学基盤機構 樺山一哉教授、深瀬浩一特任教授(常勤)と、九州大学生体防御医学研究所 和泉自泰准教授、馬場健史教授らの研究グループは、質量分析を用いて一つの細胞に含まれる成分の分布を可視化する独自のイメージング技術を開発しました。この技術は「シングルセル質量分析イメージング(SC-MSI)」と呼ばれ、生体組織や細胞の成分を可視化するために活用できます。また、本計測システムでは、蛍光顕微鏡を用いた細胞の観察と、細胞の形状情報を計測することも可能になりました(図1)。
この技術を用いて、がん細胞(HeLa細胞)の分析を行った結果、脂質の種類ごとに異なる分布を示すことを見いだしました。さらに、遺伝子プロファイルが異なる2種類のHeLa細胞を別々に計測し、脂質情報の多変量解析を行うことで、細胞の種類を区別することができました。
この技術を活用することで、病気の生体組織を形作る細胞がどのように変化するのかを、まさに“見て知る”ことができるようになり、バイオマーカーの発見や、治療・診断技術の創成につながる知見が獲得されることが期待されます。
本研究成果は、英国科学誌「Communications Chemistry」に、5月14日(水)に掲載されました。
図1. 1細胞の成分分布を可視化するための新たなイメージング技術を開発し、がん細胞に含まれる脂質の分布を2マイクロメートルのピクセルサイズで可視化することに成功した。また、同一の細胞の蛍光像と形状像も計測し、両者を相互比較することができるようになった。
研究の背景
我々の身体は、細胞が機能的・構造的に階層化された組織でできており、細胞内外の多彩な化学反応によって健康が維持されています。細胞膜の主成分として知られる脂質は、エネルギーの蓄積やタンパク質の働きの制御など、細胞内の代謝反応においても重要な役割を果たし、脂質代謝の異常は疾患をもたらします。一方で、生体組織の脂質の分布と疾患の関係は未解明な点が多く残されています。疾患の機構解明や、治療および診断の高度化のためには、生体組織を構成する一つ一つの細胞に内在する多様な分子を詳しく調べる分析技術の開発が必要とされています。
質量分析イメージング(MSI)は、質量分析の技術を応用して、研究対象物(試料)に含まれる分子の分布を画像として可視化する技術です。他のイメージング技術とは異なり、MSIは複数の分子の質量情報を精密に計測することで、構造が多様な生体分子を区別して可視化することが可能になります。MSIを実施するためには、試料の微小領域の成分を気体のイオンにして、質量分析装置で分析を行う技術が必要になります。一つの細胞の中に含まれる成分を可視化する「シングルセルMSI(SC-MSI)」が近年注目され、マイクロスケールの領域をイオン化する技術の研究開発が世界的に進められています。
大塚洋一准教授はこれまでに、「タッピングモード走査型プローブエレクトロスプレーイオン化法(t-SPESI)」の研究開発を主導し、生体組織の脂質分布の可視化に取り組んできました。t-SPESIでは、先端が数マイクロメートルの細いガラス管である、キャピラリプローブ(プローブ)を上下に振動させながら、プローブの内部に高電圧を印加した溶媒を流します。プローブの先端を試料の表面に接触させると、両者の間に溶媒の架橋(液架橋)が形成され、試料成分が局所的に抽出されます。抽出液に高電圧が印加されることで、気体状態のイオンが生成されます。生成されたイオンは質量分析装置に導入され、分析されます。プローブを試料に対して二次元方向になぞる(走査する)ことで、MSIを実施することができます。
樺山一哉教授らは、これまでに細胞の脂質や糖鎖に注目して、1細胞蛍光イメージングの研究を推進してきました。また、九州大学生体防御医学研究所の和泉自泰准教授らは、超臨界流体クロマトグラフィー/質量分析(SFC-MS/MS)を用いた細胞の代謝プロファイリングに取り組んできました。
本研究では、異分野融合研究を通じて、HeLa細胞に含まれる脂質の分布を高精細に可視化する技術を開発することを目指しました。
研究の内容
SC-MSIの実現には、高精度な計測システムの開発が必要となります。大塚准教授らは、倒立型蛍光顕微鏡との併用が可能な、コンパクトなt-SPESIユニットを新たに開発しました(図2a, b)。倒立型蛍光顕微鏡を用いることで、試料の裏側から、細胞とプローブ先端に形成された液架橋の両方を観察できるようになりました(図2c)。
実際の細胞の表面は微小な凹凸があります。凹凸のある試料上を振動するプローブが走査すると、プローブの振動の大きさ(振動振幅)が変化し、抽出とイオン化の条件が変化してしまいます。そこで、t-SPESIユニットに、①レーザー光を用いてプローブの振動振幅を計測する仕組み、②振動振幅を一定に保つために、プローブの垂直方向の位置を自動的に調整する仕組みを導入しました。①と②を組み合わせたフィードバック制御機構を用いることで、凹凸のある試料に対して一定の振動振幅で抽出―イオン化をできるようになりました。
t-SPESIではプローブの先端を細くすることで、抽出を行う領域を小さくすることができます。しかしながら、抽出の領域を小さくすると、生成されるイオンの量が減少してしまいます。したがって、抽出領域の縮小とイオンの高感度検出を両立する技術の開発が重要となります。そこで大塚准教授らは、新しいプローブを考案しました。先端を約2マイクロメートルに尖らせたプローブの内部に、多孔質のシリカ粒子を充填(じゅうてん)することにより、溶媒中の不純物がガラス管の先端を詰まらせることを抑制し、毎分数ナノリットルの溶媒を安定的に流すことができるようになりました(図3a)。また、t-SPESIで生成される気相イオンを、質量分析装置に高効率に輸送するための輸送管も試作しました(図3b)。これらの複数の要素技術を導入した新計測システムを用いることで、蛍光顕微鏡で細胞を観察した後に、同一の細胞の成分像(イオン像)と表面形状像を一度の計測で取得することが可能になりました(図4)。
本研究では、遺伝子プロファイルが異なる2種類のHaLa細胞(mCATとcGCSと示す。図5a)のSC-MSIを実施しました。ガラス基板上に培養された細胞に対して、蛍光観察用の色素導入と化学的な固定処理、不要な成分の除去処理を施しました。また、t-SPESIで計測されたイオンがどの脂質に由来するのかを推定するために、同じ種類のHeLa細胞をSFC-MS/MSで定量分析しました。
SC-MSIで取得した2種類の細胞の脂質イオンの相対的な信号強度を調べたところ、細胞間で有意に信号強度が変化する脂質イオンを発見しました(図5b, 5d-5i)。また、29種類の脂質イオンの信号強度を主成分分析した結果、異なる種類の細胞が別々のグループに分類されました(図5c)。次に、有意差が確認された脂質イオン(図5d-5i)の分布像を、HaLa細胞の蛍光像(図5a)と比較したところ、細胞の種類ごとに相対的な信号強度が変化すると共に、脂質の種類によって異なる分布を示すことを見いだしました(図5j-5o)。リン脂質の一種である、フォスファチジルコリン(PC 34:2およびPC 38:4)のイオン像では、信号強度が細胞核内では低く、核の周辺で高くなることが分かりました。細胞内小器官である小胞体やゴルジ体では、これらのリン脂質が多く含まれることが報告されています。一方、スフィンゴミエリン(SM d18:1/22:0、SM d18:1/18:2、SM d18:1/16:0)のイオン像では、PCのような局在性は見られず、より広範囲に信号強度が分布していました。この結果は、ゴルジ体で合成されたSMが細胞の表面に多く存在していることを示すと考えられます。また、糖脂質の一種であるヘキソシルセラミド(HexCer)のイオン像では、糖脂質合成酵素が高発現しているcGCS細胞において信号強度が高く、細胞内では比較的均一に分布することが明らかになりました。
図2. (a)新しく開発したt-SPESI計測システムの模式図。
(b)実験装置の写真。(c)サンプルの裏面からHeLa細胞と液架橋を光学顕微鏡で観察を行った結果。
図3. (a) SC-MSIのために開発した、キャピラリプローブの光学顕微鏡像。
(b)t-SPESIで生成されるイオンを質量分析装置に導入するためのイオン輸送管の写真。
図4. (a)蛍光顕微鏡で観察されたHeLa細胞。(b)HeLa細胞に含まれるリン脂質(PC 34:1)のイオン像。(c)イオン像と同時に取得された、HeLa細胞の表面形状像。
図5. 2種類のHeLa細胞のSC-MSIの解析結果。(a)蛍光顕微鏡による観察の結果。(b)イオンの信号強度と統計的有意差の関係(ボルケーノプロット)。ボルケーノプロットの横軸は、2種類の細胞の信号強度の比を示し、縦軸が信号強度の有意差を示す。(c)主成分解析の結果。(d-i) ボルケーノプロットに矢印で示した6種類の脂質イオンについて、細胞の種類と信号強度の比較(ボックスプロット)。ボックスプロットは、2種類の細胞データに対して、各細胞の脂質イオンの信号強度を抽出し、比較した結果を示す。(j-o)ボックスプロットに示した6種類の脂質イオン像の比較。
本研究成果が社会に与える影響(本研究成果の意義)
シングルセルMSIは、従来の手法よりも高い空間分解能で細胞の成分分布を見て知ることができるようになります。この特徴は、他の1細胞分析技術(フローサイトメトリーや蛍光顕微鏡)とは一線を画し、質量情報に基づいて多様な脂質を高精細に可視化できることから、ライフサイエンスの基礎研究や応用研究への展開が見込まれます。例えば、疾患状態の生体組織の成分の分布を細胞スケールで調べることで、バイオマーカーの発見や、病態の理解に繋がる情報が獲得できるようになると期待されます。
特記事項
本研究成果は、2025年5月14日(水)に英国科学誌「Communications Chemistry」(オンライン)に掲載されました。
タイトル:“Single-Cell Mass Spectrometry Imaging of Lipids in HeLa Cells via Tapping-Mode Scanning Probe Electrospray Ionization”
著者名:Yoichi Otsuka, Kazuya Kabayama, Ayane Miura, Masatomo Takahashi, Kosuke Hata, Yoshihiro Izumi, Takeshi Bamba, Koichi Fukase, Michisato Toyoda
DOI:https://doi.org/10.1038/s42004-025-01521-2
なお、本研究は、JST 戦略的創造研究推進事業 さきがけ「細胞の動的高次構造体」(JPMJPR20E4)、JSPS 科研費 新学術領域研究(研究領域提案型)「分子夾雑の生命化学」 (JP20H04710)、 基盤研究(B)(JP23H03711)、 挑戦的研究(萌芽)(JP23K17880)、旭硝子財団、AMED BINDS(JP23ama121055)、文部科学省 高深度オミクス医学研究拠点整備事業の支援を受けて行われました。
参考URL
大塚 洋一 准教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/7c11b03c4673bb9e.html
SDGsの目標
用語説明
- シングルセル質量分析イメージング(SC-MSI)
質量分析イメージングは、質量分析の技術を応用して、試料内の分子の分布を画像として可視化する技術です。生体組織内の分子分布を詳細に調べることで、脂質やタンパク質などが組織中でどのように分布しているかを視覚化することができます。成分の可視化には、試料を局所的に気体状態のイオンに変換し、質量分析装置で分析する技術が必要で、様々な方法が開発されています。一つの細胞の大きさよりも小さい領域をイオン化することで、一つの細胞(シングルセル)の分子の分布を可視化できるようになります。
- 質量分析
質量分析は、物質を構成する分子やイオンの質量を測定する技術です。試料に含まれる分子をガス状態のイオンに変換(イオン化)し、そのイオンを質量分析装置で高感度に検出することにより、試料に含まれる分子の種類や量を特定できます。質量分析は、分子構造の解析や物質の品質管理など、幅広い分野で活用されています。大阪大学理学研究科物理学専攻は質量分析技術の研究開発において長い歴史を持ち、質量分析の発展に貢献してきました。
- 超臨界流体クロマトグラフィー/質量分析(SFC-MS/MS)
物質は通常、「固体、液体、気体」のいずれかの状態として存在します。温度や圧力の状態を臨界点以上にすると、液体と気体の両方の性質を示す「超臨界状態」となり、この状態の物質を「超臨界流体」と呼びます。超臨界流体二酸化炭素は、臨界温度(31.1 ℃)と臨界圧力(7.38 MPa)が比較的低く、ヘキサン程度の極性を持つことから、脂質の抽出・分離プロセスに利用されています。超臨界流体二酸化炭素と順相カラムを用いた超臨界流体クロマトグラフィーを用いて、種類が異なる脂質を分離し、質量分析装置で分析することで、定量的かつ網羅的に脂質分子の情報を取得することができます。

