細菌の遺伝子分配の仕組みを解明
子々孫々まで遺伝子を伝え増殖するメカニズムの本質に迫る
概要
大阪大学大学院生命機能研究科の藤井高志研究員(現所属 理化学研究所)、難波啓一教授と、英国ケンブリッジMedical Research Council分子生物学研究所のJan Löweらの共同研究グループは、低温電子顕微鏡法 と一分子イメージング により細菌遺伝子分配 の仕組みを解明しました。
本成果は、米国科学誌「Science」の電子版で2012年10月25日(木)14時(米国東部時間)に公開されます。
研究の背景と内容
大腸菌などの細菌は細胞分裂時に、遺伝情報を格納したプラスミドと呼ばれるDNA分子を娘細胞に均等に分配する機構を備えています。多数存在するプラスミドは細胞が中央で分裂することにより約半数ずつに分配されますが、小数(4~6個)しか存在しないプラスミドは細胞全体に均等に分布していないため娘細胞に分配できない可能性があります。しかし細菌には精巧な分配機構があり、ParM, ParR, parCと呼ばれるたった3種類の分子によって実現されています。本研究ではこのプラスミドの均等分配のしくみを、ParM繊維の低温電子顕微鏡による構造解析と、ParM/ParR/parC複合体の一分子光学計測による動態観察により解明しました。ParMは筋細胞のアクチンと似たタンパク質で、らせん状に重合して繊維を形成します。ParRはこのParM繊維の先端に結合し、プラスミドを繊維の端に結合するアダプターの役割を担うとともに、ParMの重合を助けて繊維形成を4倍加速します。parCは運ばれるプラスミドの部分配列です。これまでは、一本のParM繊維の両端にParRとparCが結合し、繊維が両端方向に伸長することで一対のプラスミドを細胞両端に移動させるものと信じられていました。本研究ではこれまでの定説を覆し、2本のParM繊維が逆平行にバンドルを形成し、それぞれの片端にのみ結合したParRにより繊維が一方向に伸長しつつ、伸びるたびに逆平行スライディングを起こすことでバンドルが伸び、その両端に結合したプラスミドを細胞両端に送り届けることを明らかにしました。この逆平行バンドル化とスライディングがプラスミド均等分配の“肝”です。
本研究では、1分子光学計測によりParM繊維の逆平行バンドル化とスライディングが頻繁に起こっていることを観察しました。また低温電子顕微鏡法による高分解能構造解析 によりParM繊維の構造を明らかにし、2本の繊維からなる逆平行バンドルの原子モデルを構築して繊維間相互作用に関わるParMのアミノ酸を同定しました。このアミノ酸を変異させると2本の繊維のスライディングは見事に停止しました。つまり、機能的アミノ酸が繊維表面に存在して繊維間の自発スライディングを引き起こし、それによって逆平行バンドル化が自然と生じるらしいことが明らかになりました。これが、一対のプラスミドのそれぞれを細胞両端に向かって運搬し引き離すしくみです。
本研究成果が社会に与える影響(本研究成果の意義)
プラスミドの均等分配機構は、細胞が分裂し子々孫々まで遺伝子を伝え増殖するために必須です。生命体の増殖と遺伝子の均等分配のしくみの解明は、ヒトを含む真核生物でも重要な研究テーマです。本研究は、原核生物における遺伝子分配の最も基本的なシステムであるParMRCシステムの全貌を明らかにすることにより、遺伝子分配機構の本質に迫るものです。
特記事項
米国科学誌「Science」の電子版で2012年10月25日(木)14時(米国東部時間)[10月26日(金)3時(日本時間)]に公開されます。
論文名および著者名
A bipolar spindle of antiparallel ParM filaments drives bacterial plasmid segregation. Science in press. P. Gayathri, T. Fujii, J. Møller-Jensen, F. van den Ent, K. Namba, J. Löwe (2012)
参考図
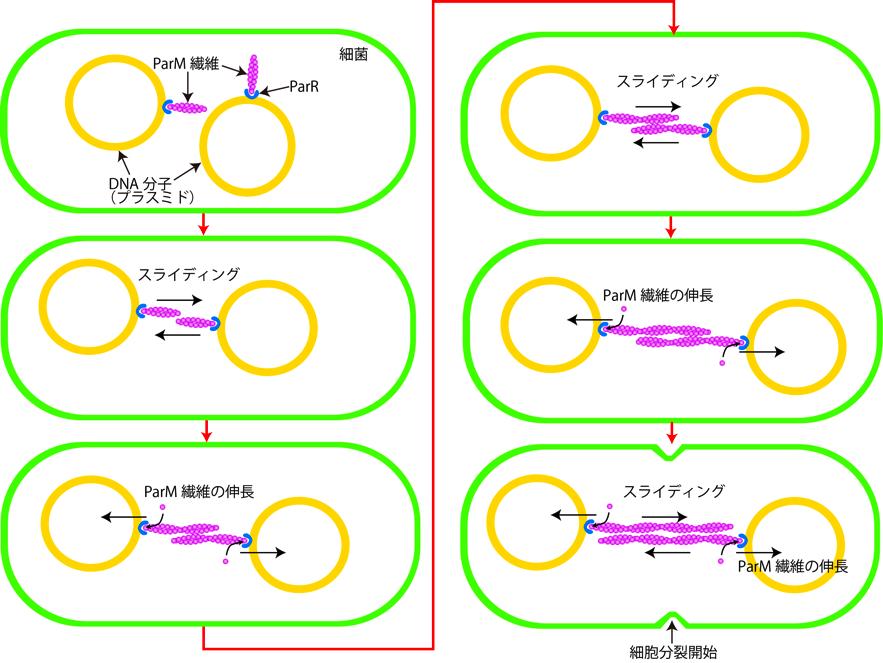
図1 ParM繊維によるDNA分子の均等分配の模式図
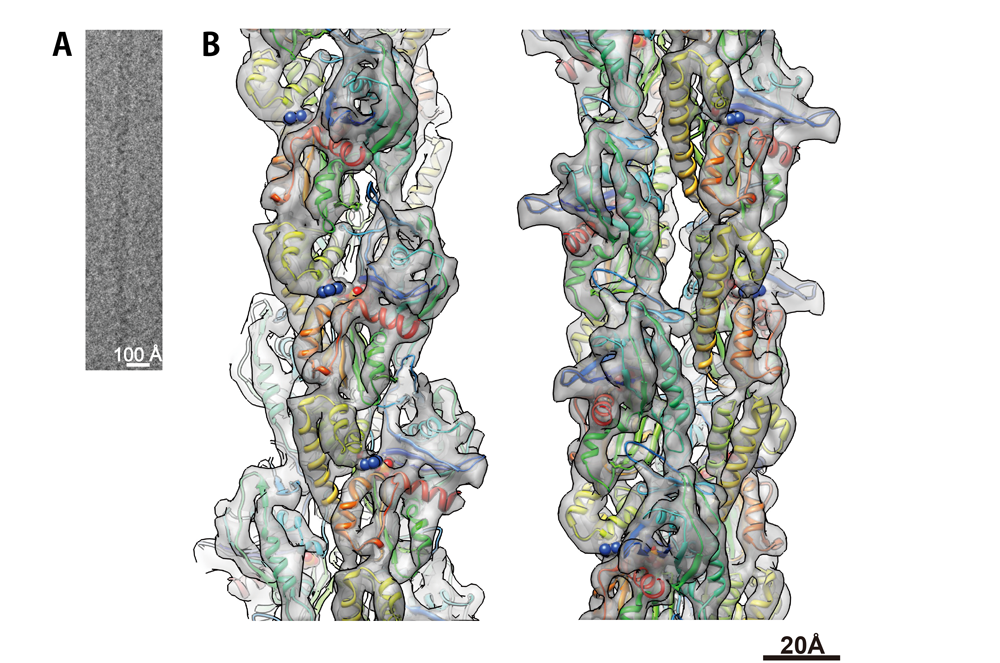
図2 低温電子顕微鏡法によるParM繊維の高分解能構造解析
(A)ParM繊維の低温電子顕微鏡像。太さ約7 nmの非常に細い繊維でありコントラストは非常に低い。
(B)ParM繊維の三次元再構成像。低コントラストの画像を数万個単位で平均化、三次元再構成することにより得られた構造。αヘリックスやβシートなどの2次構造が解像されている。
参考URL
用語説明
- 低温電子顕微鏡法
低温電子顕微鏡法では、直径0.6ミクロン程の穴が無数にあいたカーボン薄膜を載せた試料グリッド上に生体分子水溶液を載せて大半を濾紙で吸い取り、グリッドを液体エタンに突入させて急速凍結し、電子微鏡の低温試料に挿入する。こうして生体分子を50~100 nm厚の非晶質の氷薄膜中に閉じ込め、電子による投影像を撮影する。電子顕微鏡の分解能自体は個々の原子の並びを解像できるほどに高いが、生体分子は水素結合などの弱い結合で立体構造を保持しているため、電子線による損傷が極めて大きく、損傷を避けるために電子線照射量を低く抑えざるを得ないため、ノイズレベルが高くコントラストの低い像しか得られず、個々の分子像の分解能は極めて低い。高分解能の像情報が記録されているにもかかわらず、高いノイズレベルによりその情報は埋もれてしまう。ノイズを抑えて高分解能の像情報を浮かび上がらせるには、均一な構造の生体分子から数千数万もの数多くの像を収集し、その投影方向ごとに分類して整列し平均する必要がある。この分類・整列・平均により十分な数の方向で高分解能の投影像が得られれば、原理的には病院のX線CTと同じ計算法で立体像を再構成することができる。
- 一分子イメージング
生体1分子に蛍光物質などでラベリングし、その動態を光学顕微鏡でイメージングすること
- 細菌遺伝子分配
細菌の遺伝子は環状のDNA分子からなり、複製され分配されます。本研究ではその中でプラスミドと呼ばれる環状DNAがどのように均等に分配されるかを調べました。
- 高分解能構造解析
これまで、電子顕微鏡ではタンパク質分子の概形しかわかりませんでした。しかし、データ収集・解析方法の工夫などによりタンパク質の2次構造とよばれる詳細構造を明らかにすることができるようになりました。これにより、どのようにしてタンパク質がらせん状繊維構造に組み込まれるかが明らかになりました。
