生体組織の高精細マルチモーダルイメージングを実現
振動するキャピラリプローブとピコリットル液体で、生体成分と試料形状を可視化する新技術
研究成果のポイント
- 生体組織中の化学成分と試料形状などを、高空間分解能で同時にイメージングする技術を開発
- 振動するキャピラリプローブを用いて、ピコリットルの液体を試料に供給することで、生体組織の局所領域に含まれる化学成分を安定的かつ高速に抽出・イオン化し、質量分析を行うことが可能に
- 生体組織切片に前処理を施すことなく、高空間分解能で観察する本技術は、疾患組織の診断技術への応用が期待される
概要
大阪大学大学院理学研究科化学専攻の大塚洋一助教、上堀内武尉さん(研究当時:大学院博士前期課程)、竹内彩さん(研究当時:大学院博士前期課程)、松本卓也教授、静岡大学大学院光医工学研究科の岩田太教授、イタリアMolecular Horizon SrlのTortorella Sara博士らの研究グループは、高空間分解能で試料の化学成分と形状を同時に可視化するイメージング技術を開発しました。
試料に含まれる多様な成分を抽出・イオン化し、質量分析を行う質量分析イメージング(Mass spectrometry imaging)は、試料内の複数の化学成分の分布を一度の計測で捉えることができます。高空間分解能のイメージングを行うためには、試料の微小な凹凸形状や、試料を保持するための基板の傾きによる、抽出・イオン化への影響を抑制する技術が求められていました。
今回、本研究グループは、これまでに開発してきた、タッピングモード走査型プローブエレクトロスプレーイオン化法(t-SPESI, tapping-mode scanning probe electrospray ionization)に、新たに開発したプローブの振動計測技術とフィードバック制御技術を組み込むことによって、高精細の質量分析イメージングと表面形状イメージングを同時に実施する技術を実現しました。マウス脳組織切片のイメージングでは、複数の脂質成分の分布を6.5マイクロメートルの空間分解能で可視化できることを示しました。本技術は、生体組織の分子夾状状態の理解に有用であり、将来の疾病診断技術への応用が期待されます。本研究成果は米国科学誌「Analytical Chemistry」に1月6日(水)(日本時間)に公開されました。
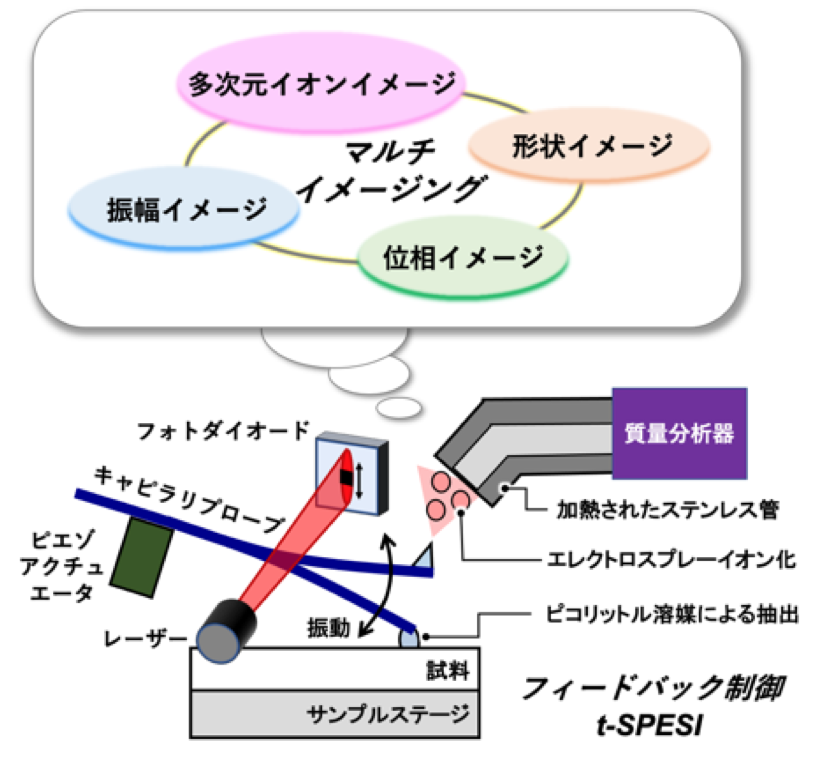
図,本研究で開発した計測システムの模式図。
t-SPESIでは、振動するキャピラリプローブから、高電圧が印加されたピコリットルの溶媒を試料表面に断続的に供給することで、試料の局所領域の抽出とイオン化を高速に行うことが出来る。キャピラリプローブの振動情報を光学的に検出し、振動振幅が一定となるように試料ステージの高さがリアルタイムに制御される。本計測システムを用いることで、質量分析イメージング、表面形状イメージング、プローブの振幅情報イメージング、プローブの振動位相イメージングを同時に行うことが出来る。
研究の背景
我々の体を構成する細胞では、脂質・代謝物・タンパク質などの分子量や化学的性質が異なる多彩な分子同士が相互作用し、生命活動に必要な化学反応が進むことが知られています。多彩な細胞がネットワークを作る生体組織では、生体分子の種類や分布が、健康状態に応じて変化することから、疾病状態の詳細な把握や診断のために、生体組織の複雑な化学種の分布状態を調べるイメージング技術が重要になります。
質量分析イメージングは、試料中の成分を抽出し、気相イオンに変換し、質量分析器に導入することで、試料内の複数の分子構造を同定し、それらの分布を可視化できます。マススペクトル情報に基づく質量分析イメージングは、他のイメージング技術と比較して、分子の種類とその分布情報を捉えられる点が特徴です。一方で、実際の生体試料は平坦ではなく、試料形状が抽出とイオン化過程に影響を及ぼすことから、高空間分解能の質量分析イメージングには、試料形状を計測しながら抽出とイオン化を行う技術が求められていました。
研究の内容
大塚洋一助教らの研究グループはこれまでに、タッピングモード走査型プローブエレクトロスプレーイオン化法(t-SPESI, tapping-mode scanning probe electrospray ionization)を開発してきました。t-SPESIは、高速に振動するキャピラリプローブを介して、高電圧が印加されたピコリットルの溶媒を試料に断続的に供給することで、試料の局所領域に含まれる化学成分を高速に抽出・イオン化することができます。イオン化にはエレクトロスプレーイオン化法(ESI, Electrospray ionization)を使用し、生体分子の構造を壊さずに気相イオンに変換します。キャピラリプローブを試料表面に対して二次元方向に走査することで、試料の座標情報に紐付いたマススペクトルを取得し、特定の化学成分の試料内分布を可視化することができます。
本研究では、試料の凹凸形状をナノスケールで計測することが可能な原子間力顕微鏡の要素技術を、t-SPESIの計測システムに融合することで、試料の形状情報をリアルタイムに計測しながら抽出とイオン化を行う技術を実現しました。キャピラリプローブの側面にレーザー光を照射することで生じる影の変位から、プローブの振動振幅を計測する技術と、振動振幅の大きさが一定に維持されるように試料ステージとキャピラリプローブの距離を調整するフィードバック制御技術を開発し、t-SPESIの計測システムに融合しました(図1)。これらの技術を用いることで、質量分析イメージング、表面形状イメージング、振動振幅変化イメージング、位相変化イメージングを同時に実施する事に成功しました。
既知の標準試料のイメージングでは、試料濃度に対するイオン強度の線形変化を確認し、マウス脳組織切片のイメージングでは、組織中の複数の脂質成分のイメージングが出来ることを示しました。高空間分解能イメージングの結果からは、空間分解能が6.5マイクロメートルであることを確認しました(図2)。
本研究成果が社会に与える影響(本研究成果の意義)
本技術は、生体組織を精細に捉えるマルチモーダルイメージングのための基盤技術として重要です。疾患組織を対象とした、多次元化学分布情報計測と特徴量の抽出法の研究を進めることにより、疾病状態の理解が進展し、病気の診断技術への応用が期待されます。
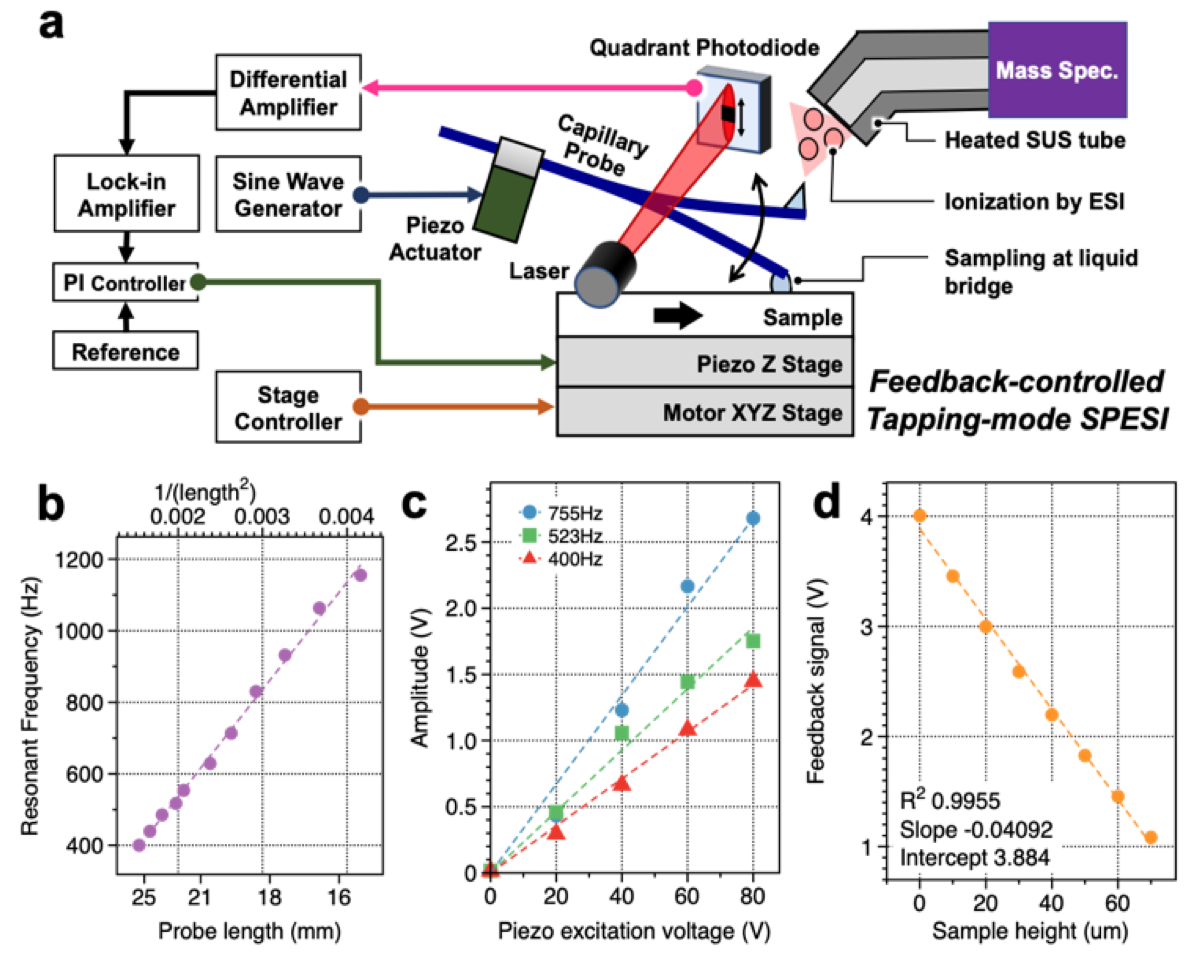
図1. (a) 本研究で開発した計測システムの模式図。振動するキャピラリプローブの側面からレーザー光を照射し、プローブの影の変位からプローブの振動振幅を計測する。振幅が一定となるように試料ステージの高さをリアルタイムで調整することによって、生体試料の凹凸の影響をなくしてピコリットル液体による抽出・イオン化を行うことが出来る。また、振動振幅の変化から生体試料の高さを計測する事が出来る。(b)キャピラリプローブの長さとプローブの共振周波数の関係。プローブの長さを変えることで、共振周波数を任意の値に設定できることを示す。(c)プローブを振動させるためのピエゾアクチュエータへの入力電圧とプローブ振動振幅の相関。入力電圧により振動振幅を調整できる事を示す。(d)試料の高さとフィードバック制御信号の相関。試料の高さに応じて、フィードバック制御信号が線形に変化することが分かる。本計測システムを用いることで、試料の高さ計測と、プローブの振動振幅を一定に保つことを同時に行うことが出来る。Reproduced with permission. Copyright (2021) American Chemical Society. https://pubs.acs.org/doi/abs/10.1021/acs.analchem.0c04144
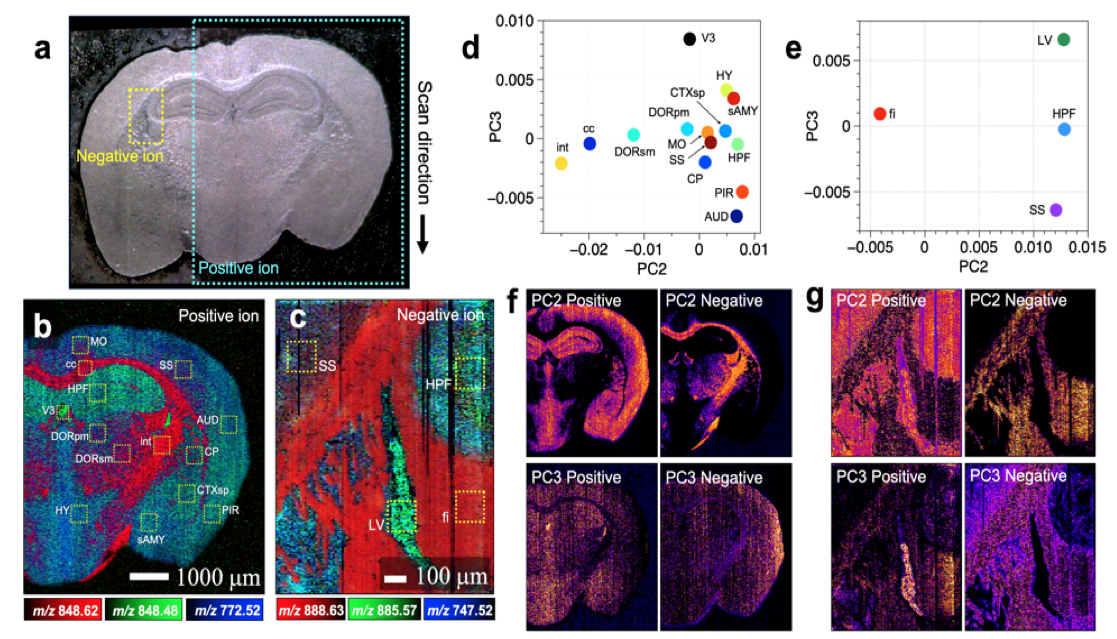
図2. (a)マウス脳組織切片の光学顕微鏡画像。(b,c) 光学顕微鏡像の二つの領域を正イオンモードおよび負イオンモードで質量分析イメージングを行った結果。(b)が正イオンモード、(c)が負イオンモードを示す。それぞれの画像は、種類が異なる3種類の脂質の分布を赤、緑、青で表現し、重ね合わせて表示した。 (c)のm/z 888.63の脂質成分の強度分布から、空間分解能が6.5マイクロメートルと見積もられた。破線の枠は主成分分析のためのデータの選択領域を示す。(d,e) (b)と(c)の選択領域に含まれるマススペクトルに対して、主成分分析を行うことで得られたスコアプロット。正イオンモードおよび負イオンモードの計測において、脳組織の領域がマススペクトル情報に基づいて分離できたことを示す。 (f,g)主成分分析で得られた第二主成分、第三主成分のスコア値の組織内分布。脳組織の構造の違いに由来する特徴量画像が得られた。Reproduced with permission. Copyright (2021) American Chemical Society. https://pubs.acs.org/doi/abs/10.1021/acs.analchem.0c04144
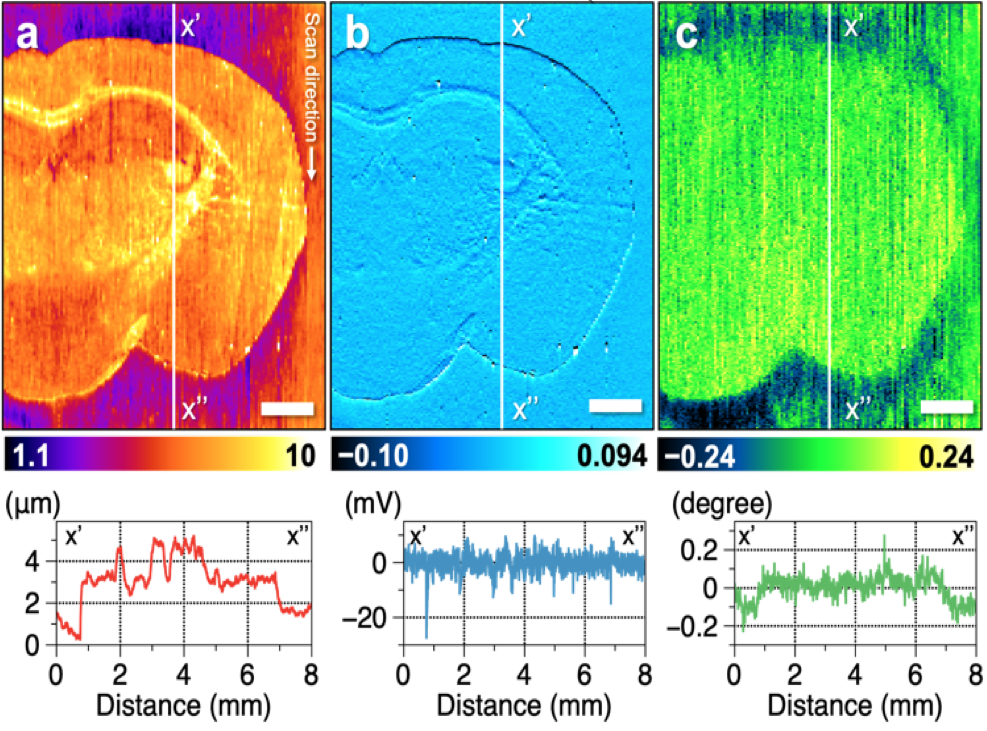
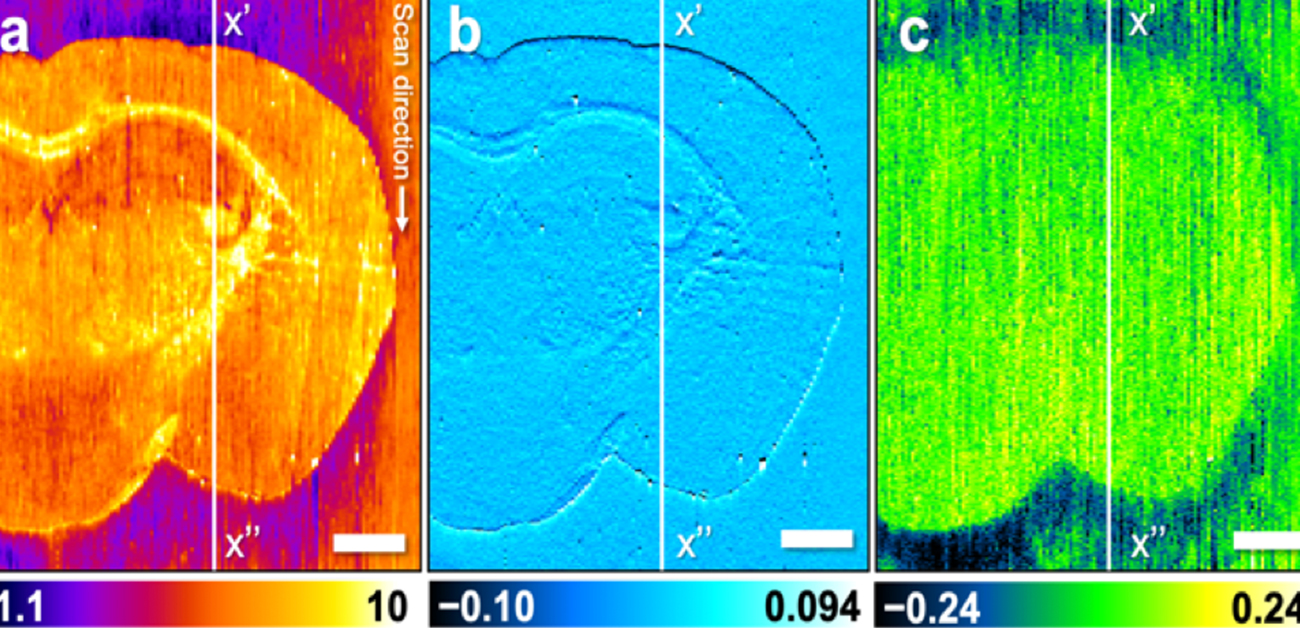
図3.本論文で発表した技術を用いて、マウス脳組織のマルチモーダルイメージングを行った結果。 各図の下に、図中の垂直方向の白線(x'-x")の断面プロファイルを示す。(a)試料表面の凹凸を示す形状イメージ。脳組織のマイクロメートルオーダーの凹凸が計測された。(b)プローブの振動振幅の変化を示す振幅像。凹凸のある脳組織をキャピラリプローブが走査した際に、キャピラリプローブの振動振幅の変化が抑制されたことを示す。(c)プローブの振動位相の変化を示す位相像。脳組織とガラス基板で、プローブの振動位相が異なったことを示す。スケールバーは1mmを示す。Reproduced with permission. Copyright (2021) American Chemical Society. https://pubs.acs.org/doi/abs/10.1021/acs.analchem.0c04144
特記事項
本研究成果は、2021年1月6日(水)(日本時間)に米国科学誌「Analytical Chemistry」(オンライン)に掲載されました。
タイトル:“High-Spatial-Resolution Multimodal Imaging by Tapping-Mode Scanning Probe Electrospray Ionization with Feedback Control”
著者名:Yoichi Otsuka1*, Bui Kamihoriuchi1, Aya Takeuchi1, Futoshi Iwata2, Sara Tortorella3, Takuya Matsumoto1
*責任著者
所属
1. 大阪大学大学院理学研究科化学専攻
2. 静岡大学大学院光医工学研究科
3. Molecular Horizon Srl.
なお、本研究は、大学共同利用機関法人自然科学研究機構新分野創成センターイメージングサイエンス研究分野プロジェクト(IS281003)、大阪大学国際医工情報センターMEIグラント、野口遵研究助成、旭硝子財団研究助成、豊田理研スカラー、JSPS科研費JP18H04554、JP 20H04710”分子夾雑の生命化学”、AMED課題番号JP20lm0203014の研究支援を受けて行われました。
SDGs目標

用語説明
- 質量分析イメージング(Mass spectrometry imaging)
試料内に含まれる化学成分の分布を可視化する方法。試料中の局所領域に含まれる化学成分をイオン化し、質量分析を行う事で、試料の座標情報と結びついたマススペクトルを計測する。マススペクトルは、複数の化学成分のイオンのm/zと信号強度の関係を示す。特定m/zのイオン強度を試料の座標情報でマッピングすることで、試料中の特定の化学成分の分布状態を可視化することが出来る。
- マススペクトル
m/z(イオンの質量を統一原子質量単位で割った量を、イオンの電荷数の絶対値で割って得られる無次元量。エムオーバーゼットと読む。)とその信号強度の関係を二次元グラフで表したもの。m/zは分子の種類に応じて一定値を示すため、マススペクトルから分子の種類を同定することができる。
- エレクトロスプレーイオン化法(ESI, Electrospray ionization)
ESIでは、試料溶液に高電界を印加することで、電荷を帯びたマイクロ液滴を生成する。帯電液滴の蒸発の過程で、溶液中の分子は溶媒和から自由になり、気相イオンに変化する。代謝物、脂質、タンパク質などの生体分子を断片化することなくイオン化できるため、生命化学研究にとって極めて重要な分析技術である。生体分子のソフトイオン化の貢献に関し、ESIの発明者(Prof. John B. Fenn)が2002年のノーベル化学賞を受賞した。
