細胞間のmRNA移動が 多能性幹細胞の運命をリプログラムすることを発見
新たな細胞間コミュニケーションの仕組みにもとづいた 細胞運命制御技術の開発に期待
研究成果のポイント
概要
東京科学大学(Science Tokyo) 総合研究院 ヒト生物学研究ユニットの武部貴則教授(兼 大阪大学大学院医学系研究科/大阪大学ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)教授)の研究チームは、大阪大学 大学院医学系研究科の米山鷹介講師(東京科学大学 総合研究院 ヒト生物学研究ユニット 非常勤講師)らとの共同研究により、iPS細胞などの多能性幹細胞を用いた実験で、さまざまな遺伝子をコードするmRNA(メッセンジャーRNA)が細胞間を移動する現象を発見しました。また、この移動したmRNAが受け取った細胞に影響を与え、その運命を転換させることも明らかにしました。
mRNAは、細胞の状態を決定する上で遺伝情報を担う極めて重要な生体分子です。近年、哺乳類において異なる種類の細胞間でmRNAが移動する現象が報告されていますが、移動したmRNAが受け取った細胞に対して生物学的に意味のある影響を与えるかどうかは未解明でした。
本研究では、ヒトとマウスの多能性幹細胞を直接接触させた共培養実験を通じて、マウス由来のmRNAがヒト細胞内に移動する現象を発見しました。このmRNA移動は、ヒトとマウスの細胞間で形成される膜突起(トンネルナノチューブ構造)によって媒介されることが確認されました。また、移動したマウスのmRNAには、TFCP2L1、KLF4やTFAP2Cなどの転写因子をコードするものが含まれており、これらの因子がヒト多能性幹細胞をより未分化な状態へリプログラムすることが判明しました。
本研究は、生体内で起こる複雑な細胞間コミュニケーションの解明に新たな視点を提供するだけでなく、iPS細胞等の作製におけるより安全な細胞リプログラミング技術の開発につながる可能性があります。
本成果は、1月22日(現地時間)付けで「Proceedings of the National Academy of Sciences」誌に掲載されました。また本論文は、PNAS: Vol 122, No 4のカバーアート(論文雑誌の表紙絵)として採用されました。
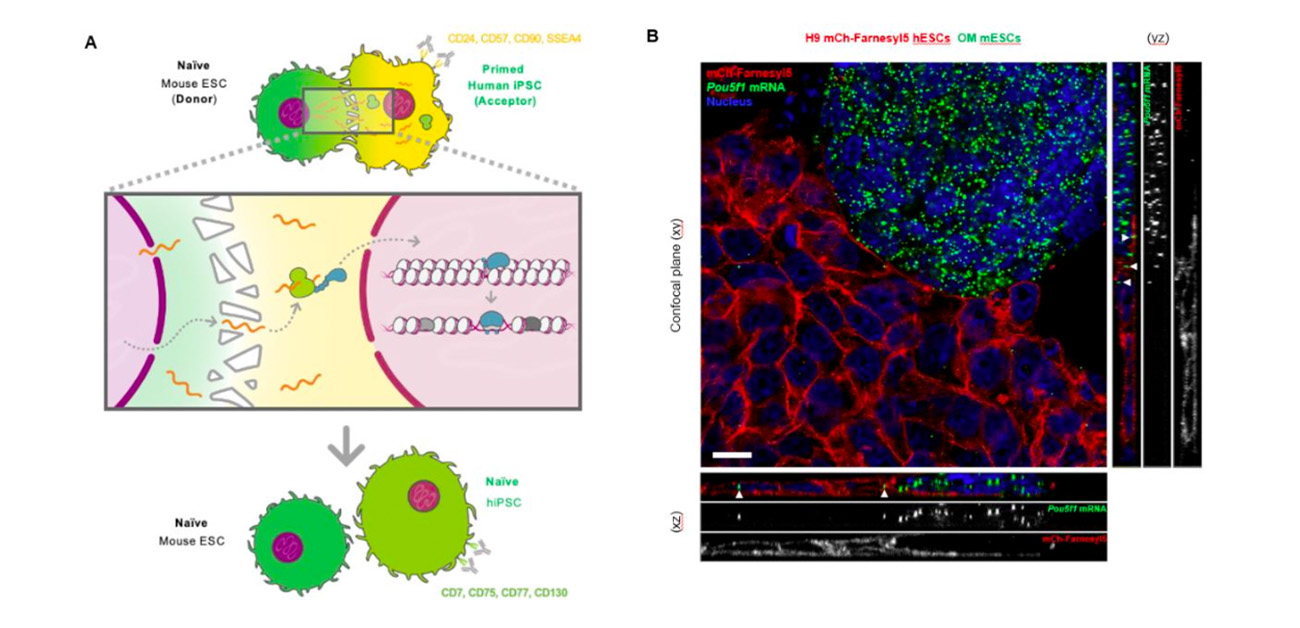
図.
A. 本研究成果の概要(イラストは、小高明日香氏の制作)。B. 赤色(細胞膜)で標識したヒトES細胞と、緑色で標識したマウスES細胞由来のmRNA(Oct4) の染色像.下端・左端の矢頭は、断面図においてマウス由来のmRNAがヒト細胞内に存在することを示す。
研究の背景
細胞間における情報伝達は、さまざまな生命現象において重要な役割を果たしています。近年、この情報伝達を担う物質としてRNAが注目を集めています。例えば、細胞が分泌する小胞(細胞外小胞)を介してRNAが細胞から細胞へと輸送され、特定の遺伝子の発現量を調節することが知られています。一方で、RNAの細胞間移動には、細胞外小胞を介さない機構も存在することが、ごく最近報告され始めました。
具体的には、細胞同士が接触している際に細胞間で管状の接続構造が形成され、これを通じてタンパク質をコードするメッセンジャーRNA(mRNA)が移動する可能性が議論されています。しかし、このようなmRNAの細胞間移動に関する現象は、哺乳類における研究ではほとんど記述がありません。また、異なる種類の細胞から送られてきたmRNAが受け取り側の細胞に与える影響については、いまだ解明されていませんでした。
本研究では、ヒトとマウスの多能性幹細胞を共培養する実験を行う中で、予期せずmRNAが両細胞間で移動している現象を発見しました。この発見をきっかけに、mRNAの細胞間移動の実態と、それが細胞の運命に及ぼす役割について検証を試みました。
研究の内容
多能性幹細胞であるES細胞やiPS細胞は、その発生分化の進行度合いに応じてナイーブ型とプライム型に分類されます。マウスのES細胞は着床前の初期胚に相当するナイーブ型であるのに対し、一般的に研究に用いられているヒトES細胞やヒトiPS細胞は、より分化が進んだ着床後胚に相当するプライム型であることが知られています。ナイーブ型とプライム型の多能性は、それぞれ異なる遺伝子ネットワークによって維持されており、適切な培養条件が必要です。そのため、プライム型のヒト多能性幹細胞をマウスES細胞用の培地で培養すると、多能性が速やかに失われます。しかし、本研究では、マウスES細胞と直接接触する形で共培養することで、プライム型のヒト多能性幹細胞がマウスES細胞用の培地にも適応し、維持されることを発見しました。
ヒトとマウスの細胞を共培養する実験系では、わずかな塩基配列の違いによって細胞自身が持つmRNAと、他の細胞から移動してきたmRNAを区別することが可能です。この実験系を用いてRNAイメージング解析やマウス特異的な遺伝子発現解析を行った結果、共培養中にマウスES細胞由来のmRNAがヒト多能性幹細胞内に移動していることが観測されました。さらに、この移動したmRNAを網羅的に解析した結果、転写や翻訳、ストレス応答などに関連するさまざまな分子をコードするmRNAがマウス細胞からヒト細胞へと転送されることが明らかになりました。加えて、このmRNAの移動は、細胞間の直接的な接触が失われると減少し、マウス細胞とヒト細胞の間に形成されるトンネル状の膜伸長構造(トンネルナノチューブ構造)を介して行われることが分かりました。
次に、マウスES細胞から転送されるmRNAの中に、多能性を維持するために必須な転写因子をコードするものが含まれていることを受けて、共培養後のヒト多能性幹細胞の形質変化を解析しました。その結果、マウスES細胞由来のmRNAを受け取ったヒト多能性幹細胞が、プライム型からナイーブ型へと状態変化することを見出しました。さらに、マウス特異的な転写因子をコードするmRNAを標的とした機能喪失実験を実施したところ、マウスES細胞由来のTFCP2L1、TFAP2C、KLF4といった転写因子をコードするmRNAが、ヒト多能性幹細胞のナイーブ型転換に不可欠であることを立証しました。
本研究を通じて、異なる哺乳類の多能性幹細胞間で移動するmRNAが、単なる移動現象にとどまらず、細胞の運命転換を引き起こす、生物学的に重要な影響を持つことが明らかになりました。
社会的インパクト
本研究は、多細胞で構成されるさまざまな生命現象において、細胞同士が協力または競合するプロセスで、一方の細胞から別の細胞へmRNAが転送される可能性を強く裏付けるものです。また、移動するmRNAは、提供する側の細胞の遺伝情報のコピーとして機能し、受け取った細胞の運命や形質に大きな変化をもたらすことを示唆しています。このように、本研究の成果は、細胞間コミュニケーションの概念を刷新する新たな原理基盤となり得ます。
さらに、再生医療などの分野で重要な細胞リプログラミング技術への応用可能性を広げることも期待されます。従来の細胞リプログラミング技術は、遺伝子の導入や化学物質の使用を伴うため、安全性や効率性に課題がありました。一方、今回発見されたmRNAの移動を利用する方法は、遺伝子改変や化学物質を必要とせず、細胞を安全かつ効率的にリプログラムする新しい手法への発展が期待されます。
今後の展開
本研究では、ヒトとマウスの多能性幹細胞の間で生じるmRNAの移動に着目しました。しかし、生理的条件や生体内においても同様のmRNAの細胞間移動が発生しているのか、さらに、局所的な細胞間コミュニケーションの破綻によって引き起こされるがんなどの疾患の発生や進行にmRNA細胞間移動が関与している可能性については、まだ解明されていません。これらの課題を明らかにするため、本研究成果を基盤として、学術研究をさらに発展させていきます。
また、従来の技術とは異なる仕組みで細胞運命を操作することができる新たな細胞リプログラミング手法の構築を目指し、技術開発を進めていきます。この新技術は、目的の細胞状態をより安全かつ効率的に誘導する可能性を秘めており、再生医療や創薬分野での応用が期待されます。
特記事項
【論文情報】
掲載誌:Proceedings of the National Academy of Sciences
論文タイトル:Intercellular mRNA transfer alters the human pluripotent stem cell state
著者:Yosuke Yoneyama, Ran-Ran Zhang, Mari Maezawa, Hideki Masaki, Masaki Kimura, Yuqi Cai, Mike Adam, Sreeja Parameswaran, Naoaki Mizuno, Joydeep Bhadury, So Maezawa, Hiroshi Ochiai, Hiromitsu Nakauchi, S. Steven Potter, Matthew T. Weirauch and Takanori Takebe
DOI: 10.1073/pnas.2413351122
本研究は、国立研究開発法人日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム 再生・細胞医療・遺伝子治療研究開発課題(基礎応用研究課題)「細胞間RNA転送によるゲノム・エピゲノム編集技術の創生」(JP22bm1123009)、AMED革新的先端研究開発支援事業(AMED-CREST)(JP21gm1210012)、AMED肝炎等克服実用化事業・再生医療実現拠点ネットワークプログラム(JP18fk0210037, JP18bm0704025, JP21bm0404045, JP21fk0210060)、JST ムーンショットプログラム(JPMJMS2033-12, JPMJMS2022-10)、JSPS科研費(JP18H02800, 19K22416)、東京医科歯科大学若手研究者奨励賞などの支援を受けて実施されました。
用語説明
- 多能性幹細胞
自身と同じ性質の細胞を作り出す能力を持つと同時に、体を構成するさまざまな細胞に分化する能力を持つ細胞。この性質を永続的に維持できると考えており、その由来によって初期胚から作製される胚性幹細胞(ES細胞)や、皮膚や血液などの体細胞を初期化することで作製される人工多能性幹細胞(iPS)細胞が知られる。
- mRNA(メッセンジャーRNA)
細胞内でDNAの情報をもとにタンパク質を作る指示を運ぶ分子。
- トンネルナノチューブ
細胞膜から突出する長くて細い管状の構造であり、異なる細胞間を接続する。トンネルナノチューブを介して、RNAのほか、タンパク質やミトコンドリアなどの細胞内小器官、カルシウムイオンなどが細胞間で移動することが報告されている。
- 転写因子
DNAからRNAを作る過程(転写)を調節するタンパク質。
- 未分化な状態
幹細胞が分化する前の、さまざまな細胞に分化する能力を持つ状態。
- リプログラミング
細胞を特定の状態に戻す、または別の状態に変える技術。
- ナイーブ型
着床前の初期胚(着床前エピブラスト)でみられる多能性に近い状態。
- プライム型
着床後の初期胚(着床後エピブラスト)でみられる多能性に近い状態。ナイーブ型よりも発生ステージが進んだ状態として、ナイーブ型とは明確に区別される。
