未成熟段階の精子が、精子運動能の鍵を握る
「電気信号」感知のタイミングを解明
研究成果のポイント
- 精子の運動能に直結する「電気信号」を、未成熟段階の精子が感知し、適切な細胞膜の脂質組成を築くことを解明
- 精子の成熟メカニズムの解明による不妊治療などへの応用に期待
概要
大阪大学大学院医学系研究科統合生理学の河合喬文助教と岡村康司教授らの研究グループはマウスを用い、精子の運動能に直結する「電気信号」について、未成熟段階の精子がその感知に関わることを解明しました。
細胞が持つ「電気信号」は私たちの身体では至るところで作られています。この「電気信号」が受け取られると、細胞にイオンの流れが生じ、生命機能に重要な役割を果たします。
これまで河合助教らは、精子が「電気信号」を感知する独自の仕組み、精子における「電気信号」が精子の運動能に重要である可能性を見出していました。具体的には、精子が「電気信号」を感じて、細胞内の酵素活性が上昇すると考えられました(Kawai et al., PNAS, 2019、2019年11月29日プレスリリース)。しかし、その「電気信号」を感じる仕組みの詳細は明らかでなく、とりわけ精子がどのタイミングで「電気信号」を感知しているかは不明でした。
今回、研究グループは精子の成熟段階に着目し、未成熟段階の精子が「電気信号」の感知に関与していることを明らかにしました。つまり、未成熟時の精子が「電気信号」を生成・感知し、細胞膜の成分組成を適切に築きあげているということになります。
本研究は、将来的には不妊治療へ応用されることも期待されます。
本研究成果は、英国科学誌「Nature Communications」に、8月24日(土)に公開されました。
図1. 「電気信号」の感知機構
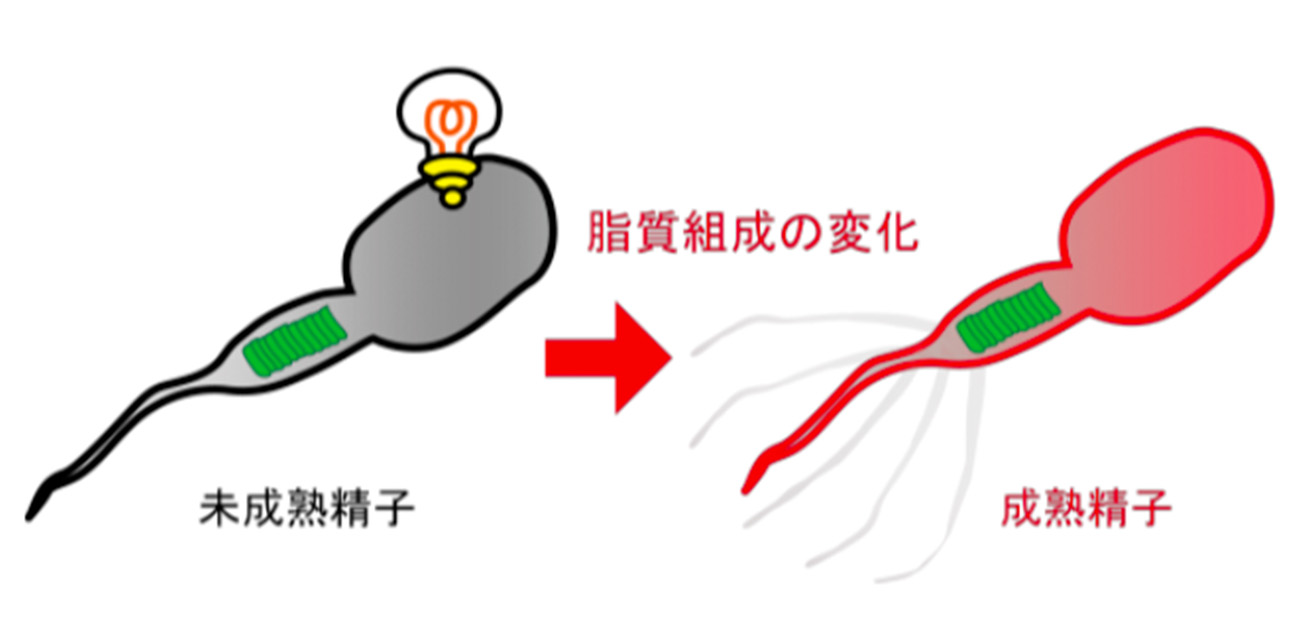
図2. 未成熟精子が「電気信号」を感知する
未成熟精子が「電気信号」を感じることで、細胞膜の脂質組成が適切に調節される。
研究の背景
我々の身体の至るところでは、膜電位と呼ばれる「電気信号」が生成されています。このような「電気信号」の生成・感知メカニズムについては主に脳や筋肉が対象として調べられており、これまでに、「電位依存性イオンチャネル」と呼ばれる分子が「電気信号」を感知することで、細胞内へのイオンの流れを引き起こすことが知られていました(図1左)。
一方、研究グループはこれまで精子に着目し、精子では「電位依存性ホスファターゼ(VSP)」という分子が機能していることを見出していました(図1右, Kawai et al., PNAS, 2019、2019年11月29日プレスリリース)。VSPは「電気信号」を感知すると酵素活性を示し、「イノシトールリン脂質PIP2」という重要な細胞膜の脂質分子量を変化させます。この機構は精子の運動制御に重要な仕組みですが、精子において、VSPがどのように「電気信号」を感知しているか、とりわけどのタイミングで感知しているのかについての詳細は不明でした。
研究の内容
今回、研究グループはマウスを用いて成熟段階の異なる精子を準備し、イノシトールリン脂質の量を測定する実験を行いました。その結果、VSPによる酵素活性の影響が成熟途中で顕著になることが明らかになりました。
また、VSPによる「電気信号」の感受性を操作した遺伝子改変マウスを作製し、その精子への影響を調べました。その結果、未成熟精子の段階で酵素活性に異常が生じ、また成熟精子の運動性にも影響が生じることが明らかとなりました。
これらの発見は、未成熟時の精子が「電気信号」を生成・感知し、細胞膜の成分組成を適切に築きあげているという、これまで想定されてこなかった新たなメカニズムを提示しています。(図2)
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、未成熟精子における「電気信号」の重要性が明らかになりました。将来的には不妊治療への応用が期待されます
特記事項
本研究成果は、2024年8月24日(土)に英国科学誌「Nature Communications」(オンライン)に掲載されました。
タイトル:“The Significance of Electrical Signals in Maturing Spermatozoa for Phosphoinositide Regulation Through Voltage-Sensing Phosphatase”
著者名:Takafumi Kawai, Shin Morioka, Haruhiko Miyata, Rizki Tsari Andriani, Sharmin Akter, Gabriel Toma, Tatsuya Nakagawa, Yuki Oyama, Rie Iida-Norita, Junko Sasaki, Masahiko Watanabe, Kenji Sakimura, Masahito Ikawa, Takehiko Sasaki, Yasushi Okamura
なお本研究は、大阪大学微生物病研究所・伊川正人教授のグループ、東京医科歯科大学・佐々木雄彦教授のグループ、新潟大学・崎村建司教授、北海道大学・渡辺雅彦教授の協力を得て行われました。また、日本学術振興会科学研究費助成事業(17K15558, 20K07274, 20KK0376, 21229003, 25253016, 19H03401)、新学術領域研究(15H05901)、学術変革研究B(20H05791)、創発的研究支援事業(JPMJFR225Z)、金原一郎記念医学医療振興財団、ひょうご科学技術協会、住友財団、小野医学研究財団、上原記念生命科学財団、千里ライフサイエンス振興財団、武田科学振興財団、持田記念医学薬学振興財団、AMED(24gm1710007)、東京医科歯科大学難治疾患共同研究拠点活動、先端モデル動物支援プラットフォームの支援を受けて行われました。
用語説明
- 膜電位
細胞の膜内外で生じている電位差のこと。細胞内外のイオン組成や細胞膜のチャネルを介したイオン透過などにより決定される。
- 電位依存性イオンチャネル
膜電位と呼ばれる電気信号を感知するための「電位センサードメイン」、並びにイオンの透過を担う「ポアドメイン」よりなる。細胞の膜電位に応じてイオン透過を行う。様々な種類の電位依存性イオンチャネルが存在し、透過するイオンの種類もK+, Na+, Ca2+など様々である。
- 電位依存性ホスファターゼ(VSP)
膜電位を感知するための「電位センサードメイン」、並びにホスファターゼ活性(酵素活性)を担う「ホスファターゼドメイン」を有する。膜電位に応じてホスファターゼ活性が制御される。2005年にその分子機能が同定された。長い間その生体内での機能は分かっていなかったが、2019年に精子の運動性に重要であることが明らかになった。
- イノシトールリン脂質PIP2
細胞膜の構成成分であり、様々な生理機能を担う。脂肪酸部分とイノシトール環部分と呼ばれる部分よりなり、このイノシトール環のリン酸基が2つあるとPIP2と呼ばれる。このうち一つがホスファターゼ活性により脱リン酸化されるとPIPとなる。
