
水素イオンを通すタンパク質がペアで働く仕組みを原子レベルで解明!
体温を上げてバイ菌から身を守る仕組みがわかった
<リリース概要>
大阪大学の藤原祐一郎助教、岡村康司教授(医学系研究科生理学講座(統合生理学))、中川敦史教授(蛋白質研究所)の共同研究チームは、我々の体がバイ菌を退治する際に、水素イオンを通すタンパク質の2つが互いに合体し、体温に合わせて体内のpHをコントロールする仕組みを原子レベルで明らかにしました。これは、我々が感染時に発熱することによる生体防御応答を考える上でも重要な発見であり、英国Nature Communications誌(5月8日16時00分グリニッジ標準時)に発表されます。
<研究の背景>
水素イオンは酸・アルカリバランスの調節や生理活性物質の原料となるなど生体にとって重要な働きを担っています。我々の体はバイ菌を退治する際に、武器として活性酸素を作っていますが、このときに大量の水素イオンが細胞内に残り、そのままでは活性酸素を作り続けることができません。この水素イオンの、いわばベントとして働いて活性酸素の産生を維持するのが、細胞膜に開いた水素イオンの通り道(水素イオンチャネル)です。これまで、この水素イオンチャネルは2つがペアとなり機能する事は知られていましたが、「どのように合体するのか?」「なぜ合体するのか?」といったことはわかっていませんでした。大阪大学の研究チームでは、2つの水素イオンチャネルが合体する領域を発見し、その原子構造を兵庫県播磨にある大型放射光施設SPring-8大阪大学ビームラインを使用して解明を進めたところ、螺旋状に合体する領域の構造は体温(37℃)付近でほどける性質を示すことがわかりました。この合体する領域を介して2つの水素イオンチャネルが互いの状態を見極めており、これによって水素イオンの通り方が体温付近で最適化されていることを明らかにしました。
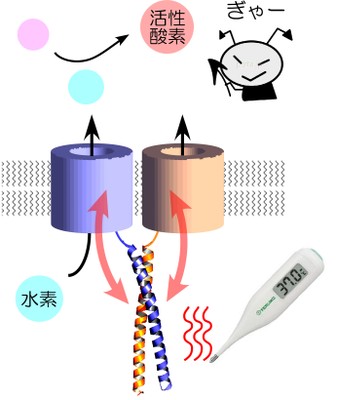
<本研究成果が社会に与える影響(本研究成果の意義)>
イオンチャネルは心疾患、神経疾患、糖尿病など、種々の疾患に関連したタンパク質で、近年薬剤開発のターゲットとして注目されています。原子レベルで生体内タンパク質の「形」と「働き」を解析した本研究の結果は、医学的に意義のある発見であるとともに、多種のイオンチャネルに共通する原理の究明に繋がり、今後、神経系や免疫関連疾患の治療薬の開発への道を開くものといえます。
<論文掲載情報>
Fujiwara Y., et. al. “The cytoplasmic coiled-coil mediates cooperative gating temperature sensitivity in the voltage-gated H+ channel Hv1”
「電位依存性プロトンチャネルHv1の細胞内コイルドコイルは2量体のゲーティング歩調を合わせ温度感知機構を担う。」
Nature Communications 誌 5月8日号(現地時間)に掲載。
<特記事項>
本成果は、文部科学省「ターゲットタンパク研究プログラム」 http://www.tanpaku.org/ による研究として得られました。
