ナチュラルキラー細胞の強力な抗腫瘍免疫を引き出す方法
mRNA分解酵素Regnase-1によるインターフェロンガンマ制御を発見
研究成果のポイント
概要
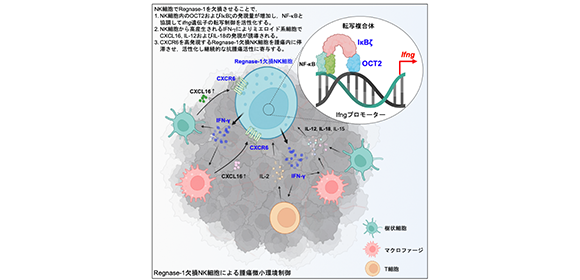
大阪大学免疫学フロンティア研究センター (WPI-IFReC)のSun Xin 特任研究員(常勤)、審良 静男 特任教授(常勤)(大阪大学先端モダリティ・ドラッグデリバリーシステム研究センター/大阪大学微生物病研究所兼任)らの研究グループは、大塚製薬株式会社 永濵 康晴 室長(大阪創薬研究センター自然免疫研究室)、Diego Diez 准教授(WPI-IFReC定量免疫学ユニット)らとの共同研究でRNA分解酵素であるRegnase-1をNK細胞から欠損させると、腫瘍内のNK細胞数とIFN-γ産生の増加によって腫瘍微小環境を変化させ、強力な抗腫瘍免疫活性を獲得することを明らかにしました(図1)。
ナチュラルキラー(NK)細胞は体外から侵入したバクテリアやウイルス、癌化した細胞等を除去することで生体防御の初期に活躍する細胞です。通常このNK細胞の機能において重要な役割を果たすのがIFN-γというタンパク質ですが、その発現制御メカニズムの詳細は完全には明らかにされていませんでした。さらに臨床の癌治療、特に抗腫瘍免疫療法においてはいかにNK細胞やT細胞を腫瘍組織内に侵入させ、活性化し、腫瘍内に留めておくかがより効果的な癌治療を目指す上での課題でした。
今回の研究では、Regnase-1欠損NK細胞と腫瘍組織の解析から、Regnase-1欠損NK細胞ではこれまでNK細胞における機能が不明であったOCT2が IκBζやNF-kBと協調してIfng遺伝子の転写を制御していることを解明しました。またNK細胞から産生されるIFN-γが腫瘍内の樹状細胞やマクロファージに働きかけることでCXCL16の発現を誘導し、CXCL16が従来一部の特殊なNK細胞でしか発現しないはずのCXCR6を高発現しているRegnase-1欠損NK細胞の腫瘍内への浸潤・保持に関わることを明らかにしました。すなわち、Regnase-1欠損NK細胞は野生型NK細胞とは異なる遺伝子発現や機能を獲得することで、自らが活性化した状態で腫瘍内に局在し続けられるように腫瘍微小環境を変化させ、強力な抗腫瘍免疫活性を示すことを明らかにしました。今後、Regnase-1の発現や機能の抑制によって強力な抗腫瘍免疫活性を有するNK細胞の腫瘍内への動員を増やし、癌の進行を抑制する新たな治療法の開発が期待されます。
WPI-IFReC自然免疫学と大塚製薬株式会社との共同研究において実施された本研究成果は、米国科学誌「Immunity」に、5月31日(金) 午前0時(日本時間)に公開されました。
図1. 本研究成果の概要
Regnase-1の欠損により、NK細胞ではOCT2-IκBζ-NF-κBで構成される転写複合体がIfng遺伝子の転写を活性化する。その結果として産生されるIFN-γを介して腫瘍微小環境を変化させ、CXCR6を高発現するRegnase-1欠損NK細胞はCXCL16によって腫瘍内に浸潤・保持され、抗腫瘍活性を示す。(Created with BioRender.com)
研究の背景
NK細胞は生体内に侵入したバクテリアやウイルス等の様々な異物を認識し排除する生体防御の初期に働く非常に重要な細胞です。NK細胞はグランザイムやパーフォリン、IFN-γといった液性因子を産生することで直接的または他の免疫細胞に働きかけ間接的に異物を除去します。さらにNK細胞は生体内の正常な細胞が変異を起こし、癌化した際にもこれらを非自己と認識し、積極的に排除することで生体が健康な状態を保てるようにしています。しかしながら、NK細胞を含む免疫系の監視から逃避した癌細胞が増殖し、腫瘍組織を形成してしまうと免疫系は癌細胞に太刀打ち出来ないようになります。この過程には様々な要因がありますが、近年の免疫チェックポイント阻害剤の癌治療への貢献から免疫系によって癌を制御出来ることが明らかになってきました。一方で抗腫瘍免疫療法の課題として、そもそも腫瘍組織の内部に癌を傷害可能な免疫細胞が存在しなければどうすることも出来ないという点が挙げられます。したがって、腫瘍組織の内部に癌細胞を傷害可能な免疫細胞を送り込み、活性化を維持した状態で腫瘍内に留めるための分子機構の解明や治療法の早急な確立が求められています。
研究の内容
野生型マウス(Reg1fl/fl)とNK細胞特異的に遺伝子組換えを誘導するためのNcr-iCreマウスを交配させ、NK細胞特異的なRegnase-1欠損マウス(Reg1ΔNK)を作製し、腫瘍免疫制御に焦点をあて機能評価を行いました。Reg1ΔNK はReg1fl/flと比較して強力な抗腫瘍活性を示す(Reg1ΔNK+抗IgG抗体)が、この活性は抗IFN-γ抗体投与によって減弱しました(Reg1ΔNK+抗IFN-γ抗体)。Regnase-1はRNA分解酵素ですが、IfngのメッセンジャーRNA(mRNA)を分解することが出来ないため、Ifng mRNAの転写制御メカニズムを解析しました。NK細胞を炎症性サイトカインであるインターロイキン-12および18 (IL-12/18)で刺激した際、Ifng遺伝子のプロモーター領域にOCT2とIκBζおよびNF-κB(p50とp65で構成されるヘテロダイマー)が同じDNA配列に結合していることが明らかになりました。さらにこれらを細胞に遺伝子導入し、Ifngプロモーターの活性を評価した結果、OCT2単独でIfngプロモーター活性を亢進させることができ、その活性化は全ての因子を同時に導入した際に最大化されました(図2)。つまりNK細胞においてRegnase-1はIfng mRNAを直接分解制御しているのではなく、OCT2やIκBζのmRNAを分解し、その発現を低下させることで転写複合体の形成を抑制し、間接的にIfng mRNAの転写を負に制御していることが明らかになりました。
図2. Regnase-1欠損NK細胞の抗腫瘍活性に重要なIfng遺伝子の発現制御機構
(左)抗IFN-γ抗体投与によってReg1ΔNKの抗腫瘍活性が顕著に減弱した。(中)Ifngプロモーター領域のDNAプローブとNK細胞核抽出物を混合し、DNAプローブに結合するタンパク質の同定を行った。(右)OCT2, IκBζ, NF-κBの各遺伝子を強制的に発現可能なプラスミドとIfng活性の上昇に応じて発光を観察可能なレポータープラスミドを細胞株に同時に遺伝子導入し、各組み合わせの影響を検証した。
腫瘍移植マウスモデルの検証からReg1ΔNKの抗腫瘍活性におけるIFN-γの重要性が明らかになったため、IFN-γが腫瘍微小環境に及ぼす影響について解析を進めました。まず癌組織のRNA発現量解析を実施した結果、細胞遊走に関わるケモカインであるCxcl16 mRNAの発現がReg1ΔNK由来の癌組織において発現上昇しており、この上昇は抗腫瘍活性を減弱させる抗IFN-γ抗体処理によって低下しました。そこでCXCL16の受容体であるCXCR6の発現をNK細胞で確認したところ、Reg1ΔNK由来のNK細胞で著しく発現が上昇していました。さらにReg1ΔNK由来のNK細胞同士の比較として脾臓に存在するNK細胞と腫瘍内に存在するNK細胞におけるCXCR6の発現を比べたところ、腫瘍内NK細胞の方がよりCXCR6を高発現していることが分かりました。そこで私たちはNK細胞からRegnase-1とCXCR6の両方を欠損させる遺伝子改変マウス(Reg1ΔNK/Cxcr6-/-)を作製し、再度腫瘍移植モデルで評価を行いました。その結果、NK細胞からRegnase-1とCXCR6両方の発現を消失させた場合には、Regnase-1単独欠損(Reg1ΔNK)で観察された強力な抗腫瘍活性が消失することが明らかになりました(図3)。すなわち、Regnase-1欠損NK 細胞の抗腫瘍免疫活性にはNK細胞がCXCR6を高発現していることに加え、この細胞の浸潤や腫瘍内での保持に関わるCXCL16の発現がIFN-γによって誘導されることが極めて重要であると結論付けられます。
図3. Regnase-1欠損NK細胞を腫瘍内へ浸潤誘導または保持するための分子機構
(左)Cxcl16 mRNAの発現誘導が抗IFN-γ抗体投与によって消失した。(中)Regnase-1欠損NK 細胞はCXCR6の発現が高く、腫瘍内に局在するNK細胞でより顕著だった。(右) Regnase-1とCXCR6を同時にNK細胞から消失させた場合に、Regnase-1の単独欠損で認められた抗腫瘍活性が減弱した。
本研究成果が社会に与える影響(本研究成果の意義)
現在の癌治療において抗PD-1抗体や抗CTLA-4抗体といった免疫チェックポイント阻害剤を用いた抗腫瘍免疫療法が血液癌やリンパ腫に対して高い治療効果を得ています。一方で抗腫瘍免疫療法は従来の抗がん剤とは異なり、固形癌に対しては期待以上の治療効果を得られていないというのが現状です。本研究成果によってNK細胞やT細胞のような癌を傷害可能な活性を持つ免疫細胞を腫瘍内に浸潤・保持させ、これらの細胞からIFN-γやグランザイム、パーフォリンなど癌細胞の傷害に関わる因子の産生を増大させることで免疫チェックポイント阻害剤の課題である固形癌に対しても効果が期待できます。さらに、Regnase-1の発現や機能阻害を標的とした抗腫瘍免疫療法は、免疫チェックポイント阻害剤やCAR-T細胞療法に代表される現在の抗腫瘍免疫療法と組み合わせることで、より一層効果的な治療に繋がることが期待されます。
特記事項
掲載紙: Immunity 2024年5月 31日 (日本時間) オンライン版
タイトル:“Deletion of the mRNA endonuclease Regnase-1 promotes NK cell anti-tumor activity via OCT2-dependent transcription of Ifng”
著者名:Xin Sun,1,2,4,* Yasuharu Nagahama,1,3,4,* Shailendra Kumar Singh,1,4 Yuuki Kozakai,1 Hiroshi Nabeshima,1,3,4 Kiyoharu Fukushima,1,4,5,6 Hiroki Tanaka,1 Daisuke Motooka,7 Eriko Fukui,8 Eric Vivier,9 Diego Diez,2 and Shizuo Akira1,4,5,10,**
所属:
1. 大阪大学 免疫学フロンティア研究センター 自然免疫学
2. 大阪大学 免疫学フロンティア研究センター 定量免疫学ユニット
3. 大塚製薬株式会社 大阪創薬研究センター 先端創薬研究所 免疫研究部 自然免疫研究室
4. 大阪大学 免疫学フロンティア研究センター 自然免疫医薬共同研究部門
5. 大阪大学 微生物病研究所 自然免疫学分野
6. 大阪大学 大学院医学系研究科 呼吸器・免疫内科学
7. 大阪大学 微生物病研究所 遺伝情報実験センター
8. 大阪大学 大学院医学系研究科 呼吸器外科学
9. フランス エクス・マルセイユ大学 マルセイユ・ルミニー免疫学センター
10. 大阪大学 ワクチン開発拠点 先端モダリティ・DDS研究センター
*同等貢献、**責任著者
DOI: https://doi.org/10.1016/j.immuni.2024.05.006
本研究は大塚製薬株式会社、日本学術振興会科学研究費助成事業(15H05704、20H00506、20H05693、20K22777、22K20760)、日本医療研究開発機構(AMED)(JP223fa627002)の支援を受けて行われました。
用語説明
- インターフェロンガンマ(IFN-γ)
主に活性化されたT細胞やNK細胞から分泌されるサイトカインで、抗腫瘍免疫応答に重要なサイトカインとして考えられている。また抗原提示細胞に働きかけ、MHC分子の発現や貪食作用を誘導する。
- Regnase-1
インターロイキン6(IL-6)等の炎症反応を引き起こす遺伝子の mRNA を分解するタンパク質(酵素)で、免疫細胞においては炎症応答を負に制御する。
- OCT2
DNAとの結合部位を持ち、遺伝子の発現を調節する転写因子と呼ばれるタンパク質。これまでにB細胞でのOCT2の役割に関する報告は多数あるが、NK細胞におけるOCT2の機能を解明したのは本研究が初となる。
- CXCR6
細胞遊走に関わるケモカインが結合するケモカイン受容体。本来成熟型のマウスNK細胞はCXCR6の発現が消失しているが,一部肝臓に局在するNK細胞が選択的に発現を維持しているとされる。
- 炎症性サイトカイン
炎症反応を引き起こす作用を持つサイトカイン。インターロイキン-6(IL-6)、腫瘍壊死因子(TNF)などが代表的な炎症性サイトカインとして知られる。生体防御において重要な役割を持つ一方で、自己免疫疾患やサイトカイン放出症候群等の炎症病態との関わりも明らかになっている。
- プロモーター領域
主にDNA配列上で遺伝子をコードする領域の上流に存在する。転写因子の結合配列に富み、プロモーター領域に転写因子が結合することで標的遺伝子(RNA)の転写(発現)を活性化または抑制する。
- ケモカイン
免疫細胞の遊走に関わる液性因子。炎症部位に存在する様々な細胞からケモカインが産生され、炎症部位の局所での免疫細胞の動員から血液中を循環している免疫細胞の動員まで幅広く作用する。
