
免疫の司令塔に大きく関与するタンパク質の同定に成功
T細胞内のRegnase-1を制御して免疫疾患の新しい治療戦略を拓く
リリース概要
大阪大学免疫学フロンティア研究センターの植畑拓也研究員、審良静男教授(拠点長)らは、獲得免疫系の中心であるT細胞においてRegnase-1というタンパク質を特異的に欠損したマウスを作成することに成功し、Regnase-1がT細胞の活性化の調節に重要な因子であることを証明しました。
さらにT細胞におけるRegnase-1が自己免疫疾患発症に大きく関与していることを世界で初めて証明しました。
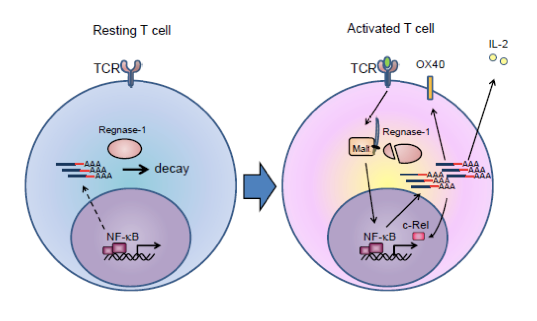
図1 T細胞におけるRegnase-1発現量のコントロール
研究の背景
自己免疫疾患の原因は多岐にわたり、そのメカニズムは明らかではありません。一般的に、体内における自己の組織を認識する自己応答性T細胞が異常な活性化及び自己抗体産生を誘導することがその主因とされますが、なぜこのようなT細胞の活性化が引き起こされるのか未だ不明な点が多い状況です。過去に審良教授らの研究グループは、自然免疫系の遺伝子としてRegnase-1を同定し、これが炎症を引き起こす遺伝子のRNAを分解し炎症を収束させる酵素であることを初めて証明しました (Nature, 2009)。しかし、これまでRegnase-1は自然免疫においてのみ重要と考えられていました。
本研究成果が社会に与える影響(本研究成果の意義)
ヒトの自己免疫疾患やその発症メカニズムは多種多様ですが、「免疫の司令塔」とも呼ばれるT細胞が重要な役割を果たしていることは間違いありません。今回作製したT細胞特異的Regnase-1欠損マウスが自己免疫疾患を自然発症することから、ヒトT細胞で発現するRegnase-1も免疫応答(炎症抑制など)に重要な役割を果たしていることは明らかです。そこで、T細胞におけるRegnase-1を標的とした治療戦略は多様な免疫疾患に対する有力手段になる可能性があります。さらに、病原体や癌に対して機能するT細胞においてRegnase-1をコントロールすることで治療効果の増大を期待することができます。以上より、今後Regnase-1を制御する因子の同定は、こうした研究領域の飛躍的な発展と社会への大きな貢献が期待されます。
特記事項
本成果は、2013年5月23日の正午(アメリカ東部時間)に雑誌「Cell」オンライン版に掲載されます。Cell press社からも特に注目される論文としてアメリカでプレスリリースされます。なお本研究は、内閣府/日本学術振興会・最先端研究開発支援プログラムの支援を受けて行われました。
研究の詳細な説明
研究の背景
自然免疫担当細胞によって認識された病原体や自己組織は獲得免疫担当細胞、即ちT細胞及びB細胞、へ抗原提示され抗原特異的な免疫反応を引き起こす。これまでに我々はマクロファージにおいてToll like receptor刺激によって誘導される因子としてRegnase-1を同定し( 図2 )、世界で初めてこれがRNAを分解するヌクレアーゼであることを発見した(Matsushita et al., Nature, 2009、Iwasaki et al., Nature Immunology, 2011)。そこで我々はRegnase-1を「RNaseを特徴とする制御因子」にちなみRegulatory RNase-1 (Regnase-1)と命名した。我々が独自に作製したRegnase-1欠損マウスは血中に自己抗体が認められ、マクロファージをはじめT細胞やB細胞にも異常な活性化が認められていたが、その病態メカニズムは明らかではなかった。
Regnase-1欠損T細胞による自己免疫疾患
我々はRegnase-1欠損(Reg1 KO)マウスに認められる自己免疫疾患が、どの細胞種によって引き起こされるのかを調べるため、T細胞特異的Regnase-1欠損(T-Reg1 KO)マウスを作製した。このマウスは著明な脾腫( 図3 )及びリンパ節腫大を認め、17週齢までにほとんどが死亡に至った。血液中の免疫グロブリン値は高値であり、ヒトの自己免疫疾患にも認められる抗核抗体も陽性であった。さらに、脾臓細胞を用いてFACS解析を行ったところ、T細胞はほぼ全てCD62loCD44hiエフェクターT細胞となっており( 図4 )、さらに多くのB細胞は抗体産生を司る形質細胞に分化していた。また、このRegnase-1欠損T細胞は野生型と比較して刺激依存的にIFN-γ、IL-4、IL-17といったサイトカインを多く産生した。これらの結果はReg1 KOマウスに観察される結果と矛盾しないことから、Regnase-1欠損によって観察された病態はT細胞によって引き起こされることが示された。
さらに我々はマウス個体内でRegnase-1欠損T細胞がどのように病態に寄与するのかについて検討を行った。まず、T-Reg1 KOマウスではほとんどのT細胞がすでにエフェクターT細胞となっているため、免疫の実験手法としてこれまで用いられてきたOT-IIトランスジェニックマウス(トリ卵白アルブミン(OVA)に対するT cell receptorを発現する)と交配させた。このOT-II遺伝子を有するT-Reg1 KOマウスでは、OVAテトラマーをもつCD4 T細胞の多くがナイーブT細胞として存在していた( 図5 )。そこでナイーブCD4T細胞のみを単離し、野生型マウスへ移入した後OVAで免疫を行った。注目すべきことに、移入マウス内においてコントロールと比較しT-Reg1 KOマウス由来のナイーブT細胞は3~6倍に増殖していた( 図5 )。またこの移入マウスから脾臓細胞を単離しOVAペプチドで刺激すると、KOを移入した側では著明な細胞増殖を呈し、さらにIFN-γ、IL-4、IL-17などのサイトカインを多く産生することが分かった。これらの結果よりRegnase-1欠損T細胞抗原刺激依存的に異常な応答を示すことがわかった。おそらく、自己抗原に対してもこのRegnase-1欠損T細胞は異常応答を示すと考えられる。従って、Regnase-1はT細胞に対して抑制的に機能しており、さらに自己免疫疾患発症にとって重要であることが判明した。
転写因子c-RelはRegnase-1欠損マウスにおいて増悪因子として働く
我々はこれまでにRegnase-1が制御しているmRNAとしてIL-6やIL-12p40などの炎症性サイトカインを同定したが、これらサイトカインをコードする遺伝子を欠損しても、Regnase-1欠損によって引き起こされる病態は改善しなかった。そこで我々はT細胞における新規Regnase-1標的RNAを同定するため網羅的遺伝子発現解析を行った。Regnase-1欠損CD4T細胞では多くの活性化に関与するサイトカイン、レセプター、転写因子などを高発現しているが、これらがRegnase-1によって直接コントロールされているかどうかはこの段階では明らかではない。そこで、ルシフェラーゼ遺伝子下流にmRNA 3' UTRを結合させレポーターアッセイを行った。結果、c-Rel mRNAは3' UTRを介してRegnase-1によって直接分解されることがわかった。一方、その他のNF-κB familyに属する転写因子はRegnase-1による制御を受けていなかった。我々はこの転写因子c-Relに注目し、Reg1 KO マウスにおいてc-Relが病態に寄与しているかどうかを調べるため、c-RelとRegnase-1のダブルノックアウト(DKO)マウスを作製した。このDKOマウスの脾臓細胞中におけるCD4T細胞の活性化はReg1 KOマウスと比較し減弱しており、ナイーブからエフェクターT細胞への変化も部分的ではあるが改善した。さらに、DKOマウスの脾臓における形質細胞の蓄積もまたReg1 KOマウスと比較し大きく減少していた。このことから、c-RelはRegnase-1標的因子として病態悪化に寄与していることがわかった。
Malt-1はRegnase-1を切断しT細胞の活性化を促す
すでに述べたようにT-Reg1 KOマウスは自然発症的にT細胞の活性化を引き起こすが、野生型マウスにおいて実際にRegnase-1蛋白量が変化しT細胞の活性化に寄与しているのかどうかは不明である。そこで我々はT細胞においてRegnase-1がどのように制御されているのかを検討した。まず野生型マウスよりCD4T細胞を単離した後、in vitroにおいて抗CD3/CD28抗体あるいはPMA/Ionomycinで刺激しRegnase-1蛋白レベルを調べたところ、刺激前ではRegnase-1はすで発現しており、刺激後その蛋白レベルは減少した( 図6 )。このことからRegnase-1は恒常的に発現しておりTCR刺激依存的に減少することがわかった。次に、我々はこの刺激依存的なRegnase-1蛋白レベル減少のメカニズムについて検討を行った。従来TCRシグナルにおいて重要な要素とされているMalt1はcaspase様のドメインを有しており、実際にいくつかの分子を標的とし切断することによってT細胞の活性化に寄与することが知られている。我々はこのMalt1に着目し、このparacaspase特異的なinhibitorを用いて、刺激後のRegnase-1蛋白の変化を調べた。この結果、T細胞で認められたRegnase-1蛋白レベルの減少はinhibitor存在下では抑制されることがわかった。さらに、Malt1ノックアウトマウス由来のT細胞ではこのRegnase-1蛋白レベルの減少は全く起こらなかった( 図6 )。これらの結果よりRegnase-1はMalt1によって制御されていることがわかった。また、実際にOT-IIマウスにOVAを用いて免疫した場合においても、T細胞内のRegnase-1蛋白レベルは減少していたことから、この現象はin vivoにおいても再現されることがわかった。
以上より、Regnase-1はT細胞において刺激依存的にその蛋白量を変化させることでT細胞の活性化に寄与していることがわかった。
まとめと今後の展開
本研究において我々はRegnase-1がT細胞において活性化を制御する重要な因子であることを示した。当初、Regnase-1はマクロファージにおいてLPS刺激によって誘導される因子として同定されたが、T細胞ではRegnase-1欠損によりまるで抗原刺激を受けたような強い活性化を引き起こす点で非常に興味深い。さらに、このような活性化T細胞は自己反応性B細胞をも活性化し、自己抗体産生を引き起こすことから、Regnase-1は末梢での自己寛容を制御していると言える。一方で、T細胞は抗原刺激を受けることでRegnase-1の発現量を厳密にコントロールしており、一過性にRegnase-1の発現量を減らすことで免疫応答を容易にしているが明らかとなった( 図7 )。
注目すべきことに、刺激後におけるRegnase-1の発現変化はマクロファージにおいても認められるが(Iwasaki, Nature Immunology, 2011)、T細胞の場合、これまでNF-κB活性化に必須とされていたMalt1がRegnase-1を切断することにより、標的RNAの安定性を制御する点は革新的である。以上から、Regnase-1は自然免疫系だけでなく獲得免疫系においても免疫活性化を調節する重要な役割を担っていることが明らかとなった。
Regnase-1はリンパ球に多く発現することが知られているが、 CD4陽性T細胞の中でも抑制性T細胞やCD8陽性である細胞障害性キラーT細胞なども疾患に関与していることが予想される。このような細胞は自己免疫疾患やウイルス感染、癌免疫との関わりが深いことから、今後このような細胞種においてRegnase-1の機能を明らかにすることは重要である。一方、ヒトにおけるRegnase-1のデータは現在のところ乏しいが、関節リウマチ患者由来の滑膜細胞におけるRegnase-1はIL-6 mRNA発現を制御しているという報告は我々のデータと合致する。また心筋細胞特異的にRegnase-1を発現させたマウスでは敗血症による心筋の炎症、さらに心機能低下を緩和することができると報告されている。T細胞におけるRegnase-1の発現量は細胞活性化に大きく影響を与えることから、疾患に関連する抗原特異的なT細胞のみを活性化させることで免疫機能をコントロールできる可能性がある。今後、ヒトにおける疾患とRegnase-1がどのように関わっているか明らかにすることは大変意義深い。
参考図

図2 各遺伝子型由来のマクロファージをLPSで刺激したときのMyD88依存的な遺伝子発現を比較
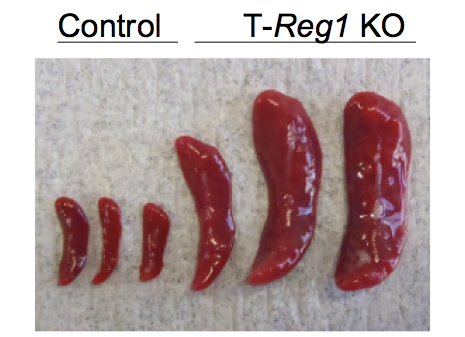
図3 野生型(control)及びT細胞特異的Regnase-1欠損マウス(T-Reg1 KO)の脾臓

図4 脾臓細胞におけるCD4陽性T細胞中のナイーブ細胞及びエフェクター細胞の割合
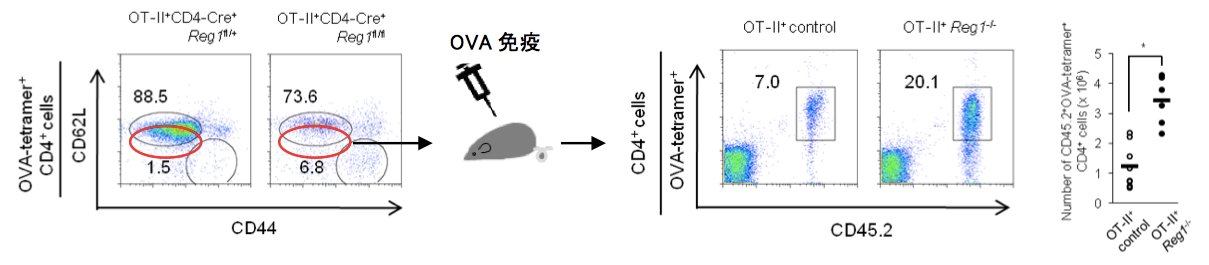
図5 OVA-tetramer陽性CD4T細胞におけるナイーブ及びエフェクター細胞の割合,及び,免疫5日目におけるCD4T細胞中の移入T細胞の割合、及び細胞数
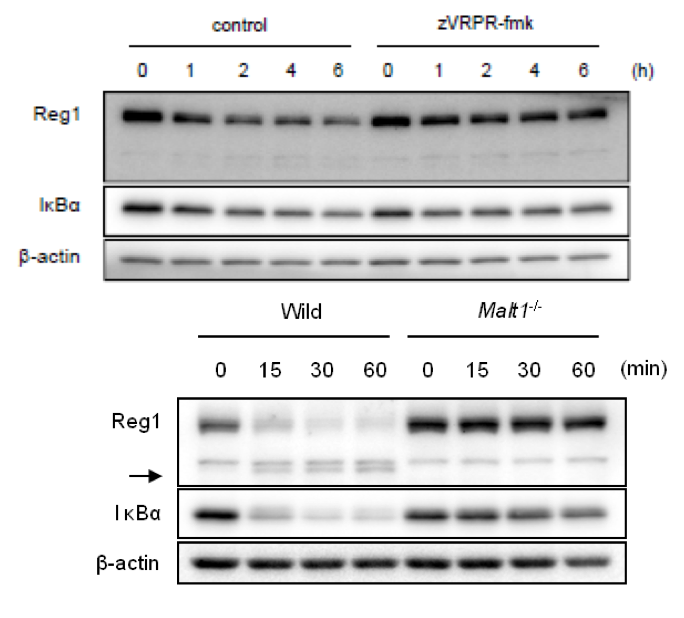
図6 野生型マウス由来CD4T細胞をMalt1 inhibitor (zVRPR-fmk)存在下で刺激(上段)。
野生型あるいはMalt1欠損マウス由来CD4T細胞をPMA/Ionomycinで刺激(下段)。
それぞれ、Regnase-1 (Reg1)蛋白の変化を示した。矢印はReg1蛋白の断片を示している。
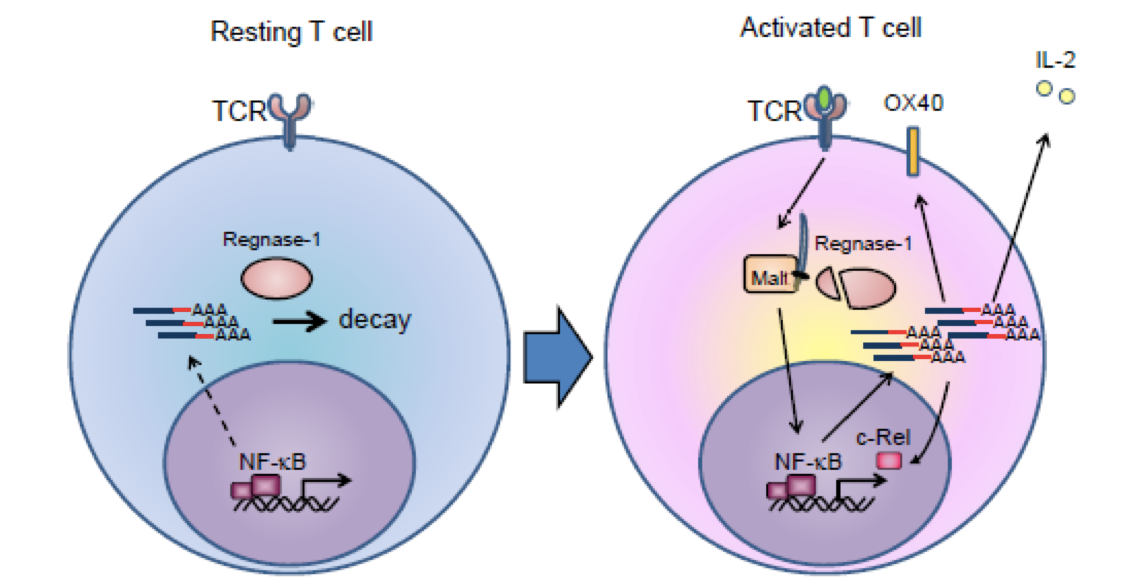
図7 T細胞刺激前後におけるRegnase-1を中心とした模式図
掲載論文・雑誌
"Malt-1-induced cleavage of Regnase-1 in CD4+ Helper T cells regulates immune activation"
(CD4陽性ヘルパーT細胞においてRegnase-1はMalt-1による切断により免疫活性化を制御している)
掲載誌: Cell 2013年5月23日(12:00pm 米東海岸)(日本時間: 5月24日(金)午前2時)online掲載予定
