光から影へ 進化の過程で隠された自然免疫システムの原始機能
自然免疫システムが背と腹の境界を作り出すことを解明
研究成果のポイント
- 自然免疫を作動させるシステムとして広く知られるToll様受容体(TLR)-NFκB経路が、脊椎動物において背腹軸形成に重要な機能を果たしていることを明らかに。
- 従来の遺伝子ノックアウト法では、遺伝的補償によりTLR-NFκB経路の本来の機能は不明であったが、ゼブラフィッシュを用いた独自の手法を駆使し機能を暴き出した。
- この手法により、TLR-NFκB経路は背と腹の境界が適切に形成されるようWnt/β-catenin経路の活動を適度に抑制する役割を担うことを解明。
概要
大阪大学微生物病研究所の石谷太教授、同大学医学系研究科博士課程のZou Juqiさん(博士課程)らの研究グループは、自然免疫システムの隠された原始的機能を暴くことに成功しました。
TLR-NFκB経路は、自然免疫を作動させる細胞内情報伝達システムとしてよく知られていますが、もともとは昆虫の胚の背と腹の違い(背腹軸)を生み出す因子として三十年以上前に発見された経路でした。昆虫での発見を契機に脊椎動物の背腹軸誘導におけるTLR-NFκB経路の機能解析が行われてきましたが、遺伝子ノックアウト解析では期待する結果を得ることができず、その関連は証明されていませんでした。また、脊椎動物の背腹軸形成ではWnt/β-catenin経路の活性化をトリガーとして生じることが明らかにされ、現在では胚発生研究においてはTLR-NFκB経路は日陰の存在でした。研究グループは、イメージング解析に適したモデル脊椎動物である小型魚類ゼブラフィッシュを用いてTLR-NFκB経路の活動を可視化する独自のアプローチを行いました。その結果、初期胚においてTLR-NFκB経路がWnt/β-catenin経路と同じ領域で活性化することを初めて突き止めました。さらに、従来の遺伝子ノックアウト法では遺伝的補償により遺伝子機能を解析しにくいことに気づき、遺伝的補償を回避できる方法で機能解析を進めた結果、TLR-NFκB経路がWnt/β-catenin経路の活動を適切に抑制することで、オーガナイザーのサイズ、ひいては背と腹の境界が適切に形成されることを突き止めました(図1右)。
つまり、昆虫の背腹軸形成においては主役であったTLR-NFκB経路が、脊椎動物背腹軸形成においては主役の座をWnt/β-catenin経路に譲り、その活動を適切に調節する重要な名脇役となっていることがわかりました。
この成果は、動物発生メカニズムの無脊椎動物から脊椎動物への進化のプロセスに新たな理解と視点をもたらし、また、これまで遺伝子ノックアウト研究で見落とされてきた重要な生命現象を解き明かす道を切り拓くものでもあります。本研究成果は、11月8日(水)にネイチャー姉妹誌「ネイチャーコミュニケーションズ」に掲載されました。
図1. ショウジョウバエとゼブラフィッシュの背腹軸形成の違いと新モデル
研究の背景
多細胞生物の三次元的な体はいかにして作られるのか?: 多細胞生物は、背腹軸、前後(頭尾)軸、左右軸、遠近軸に沿って細胞や組織・器官を配置することにより、三次元的で非対称な体を作り出します。こうした体軸形成は体づくりの最も根本的なイベントです。特に、胚の背腹軸の決定は、脳神経系を作る領域(脊椎動物では背側、昆虫では腹側にできる)と循環器・消化器系を作る領域(脊椎動物では腹側、昆虫では背側にできる)を最初に決定するイベントであるため、多くの生物学者の興味をひいてきました。そして、背腹軸の決定メカニズムの理解は、2つの発見をきっかけに発展してきました。一つは、「脊椎動物におけるオーガナイザーの発見」、もう一つは「昆虫におけるTLR-NFκB経路の発見」です。
オーガナイザーによる脊椎動物の背腹軸形成: 今から100年ほど前に、ハンス・シュペーマン(Hans Spemann、ノーベル賞受賞者)とヒルデ・マンゴールド(Hilde Mangold)によるイモリ胚を用いた実験により、背側オーガナイザー(シュペーマン/マンゴールド・オーガナイザー)が発見されました。背側オーガナイザーは脊椎動物胚の将来背側になる部位に存在する組織領域であり、この組織を腹側に移植すると二つ目の脳神経組織(頭部)が誘導されることから、「動物の背側を決定づけ、神経形成を誘導する領域」として注目されました。その後の解析により、オーガナイザーの形成は、細胞外シグナルタンパク質WntによるWnt/β-catenin経路の活性化をトリガーとして生じることや、形成されたオーガナイザーが分泌されたコーディン(Chordin)と呼ばれるタンパク質を分泌して、BMPと呼ばれる背側形成を抑制して腹側形成を促進する分子の活動を抑制することで背側領域の組織(神経系など)を誘導することが明らかになっています(図1中央)。一方、オーガナイザーは背側の特定の領域に誘導されるため、その領域のサイズを制限するメカニズムが存在すると考えられるますが、そのようなメカニズムは不明でした。
昆虫の背腹軸形成機構: クリスティアーネ・ニュスライン=フォルハルト(Christiane Nüsslein-Volhard、ノーベル賞受賞)らは、1980年代にショウジョウバエの背腹軸の決定に必要な遺伝子としてToll遺伝子(受容体をコード)を発見しました。さらに、その後の解析により、ショウジョウバエ胚の腹側でToll受容体が活性化してその下流の転写因子NFκB を活性化し、活性化したNFκBがToll受容体抑制因子WntD(脊椎動物Wntの相同タンパク質)を発現誘導することでToll/NFκB 経路の負のフィードバック制御が起き、これによりオーガナイザー様の領域が腹側に形成することがわかりました。また、ショウジョウバエ胚予定背側領域からは、BMPの相同タンパク質Dppが分泌されて腹側の形成を抑制し、オーガナイザー様領域からはBMP抑制因子Sog(コーディンの相同タンパク質)が分泌されてDpp(BMP)と拮抗することで背腹軸パターンを生み出すことも明らかになりました(図1左)。このシステムはショウジョウバエのみならず他の昆虫でも使われていることもわかっています。すなわち、オーガナイザーが形成される部位は昆虫と脊椎動物で反転(それぞれ腹側と背側)しているものの、昆虫でも脊椎動物でも、オーガナイザー形成にはWntが関わり、オーガナイザーからコーディンが分泌されてBMPを抑制することで背腹軸が確立されます。
自然免疫システムの原始的機能は失われたのか?: 上述の事実は、Toll-NFκB経路が脊椎動物の背腹軸形成に関わる可能性を期待させます。脊椎動物でもTollの相同タンパク質としてToll様受容体(TLR)ファミリーが知られ、転写因子NFκBのファミリー遺伝子群も複数存在しており、多くの生物学者がこの可能性に期待しました。しかし、脊椎動物ではTLR-NFκB経路の自然免疫システムとしての機能が次々と明らかにされる一方で、個々のTLR-NFκB経路の構成因子をノックアウトしても背腹軸の異常が見られないことからTLR-NFκB経路の背腹軸への関与は明らかにすることができないまま時間が過ぎていきました。そして、TLR-NFκB経路の原始的な役割である体軸誘導は脊椎動物では失われてしまっているかもしれない、とも思われていました。
研究者の決心: 研究チームのリーダーである石谷教授は、学生時代に遺伝学の教科書を読んで「ショウジョウバエToll-NFκB経路による背腹軸形成のメカニズム」を知り、そのエレガントなシステムに強い衝撃を受けました。そして、動物発生のメカニズムに興味を持ち、大学院生時代から動物の体作りのメカニズムの研究を行い、背腹軸・前後軸形成におけるWnt/β-catenin経路の新たな機能と制御機構などを明らかにしてきました(IshitaniらNature 1999; Ishitaniら Nature Cell Biol 2005; AkiedaらNature Commun 2019など)。一方で、学生の頃に抱いた疑問である「TLR-NFκB経路は脊椎動物背腹軸も制御するのか」は、未だ誰もしっかり証明できないまま時間が過ぎていきました。時を経て研究室を率いる立場になった石谷教授は、以前より気になっていたこの疑問に自ら取り組む決心をしました。
研究の内容
壊すのではなく、ありのままを見る: 遺伝子の機能を知る上で最も強力な方法は、その遺伝子を破壊(ノックアウト)して、その影響を調べる方法です。しかし、上述のようにノックアウトではTLR-NFκB経路の背腹軸への関与は解き明かすことができません。そこで研究チームは、TLR-NFκB経路のありのままの活動を可視化しようと考えました。研究チームは、イメージング解析に適したモデル脊椎動物であるゼブラフィッシュを用いて、動物を生かしたまま全身の細胞内情報伝達経路の活動を可視化する技術を以前に開発しており、この手法を用いて、胚発生過程におけるTLR-NFκB経路の活動を可視化しました。その結果、初期胚においてTLR-NFκB経路がWnt/β-catenin経路と同じ領域(将来背側になる領域)で活性化することを初めて突き止めました。この観察により、TLR-NFκB経路が脊椎動物背腹軸形成に関わるであろうという確信を得ました。
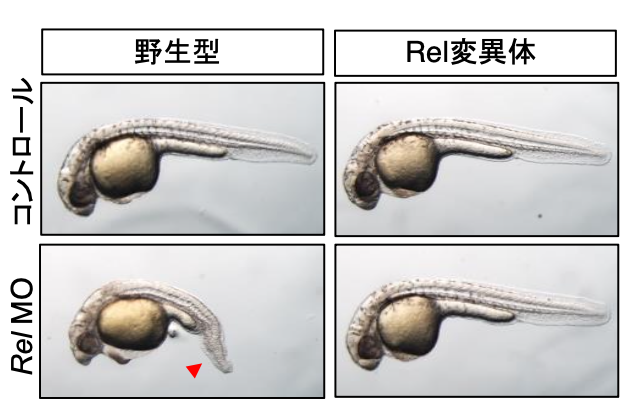
矛盾した事実: そこで、TLR-NFκB経路が脊椎動物背腹軸形成に関わることを実証するために、この経路を阻害する実験を行いました。初期胚で発現レベルが高いNFκBファミリータンパク質であるRelに注目し、Relに対するモルフォリノアンチセンスオリゴを初期胚に注入し、Rel機能阻害個体を作製しました。Rel機能阻害個体では背側オーガナイザーのサイズが拡大して背腹軸に異常が生じ、腹側組織が縮小して背側組織が大きくなりました。また、Relに結合してその活性を抑えるタンパク質IκBを胚に導入した際も同様の表現型が見られました。この結果は、Relがオーガナイザーの形成とそれに伴う背側組織の形成を抑制することを示しています。そこで、この仮説をさらに検証するために、ゲノム編集を使ってRelノックアウト個体を作製しました。ところが、ノックアウト個体は全く異常を示さず、正常に発生しました。この結果は、Rel機能阻害個体の結果と矛盾しますが、一方で、マウスなど他の動物種でRelをノックアウトした場合も体軸形成に異常が出ないという事実とは合致します。では、なぜ、機能阻害個体とノックアウト個体の違いが生じるのでしょうか?以前より、遺伝子機能を完全に無くす「ノックアウト」が最も信頼がおける方法であり、アンチセンスやRNAiなど機能阻害でノックアウトよりも強い表現型が見えたら「オフターゲット効果」を疑うべきだと考えられてきました。オフターゲット効果とは、機能阻害に使ったアンチセンスなどが目的の遺伝子以外にも効いてしまう現象を指します。では、機能阻害で見えた現象は嘘(Rel以外の遺伝子が阻害された結果として見えた結果)だった、のでしょうか?
遺伝的補償により隠された機能: 一方で、近年の研究により、ノックアウトでは遺伝的補償により遺伝子本来の機能が隠されてしまうケースがあることが明らかにされつつあります。研究グループはこの可能性に期待し、Relノックアウト個体についてもう少し詳しく調べました。その結果、Relノックアウト個体では、本来正常個体では機能していないRel類似タンパク質Relaの発現が上昇し、Relの機能を肩代わりしてしまっており、そのせいで異常が生じないことがわかってきました(図2)。事実、Relaに対するモルフォリノアンチセンスオリゴをRelノックアウト個体に打ち込むと背腹軸に異常が生じ、一方で野生型にこれを打ち込んでも異常は生じません(図2)。また、Relノックアウト個体(Relに対するモルフォリノアンチセンスオリゴが作用するmRNA配列が失われている)にRelのモルフォリノアンチセンスオリゴを打ち込んでも全く異常が生じない(図2)ことから、我々が使用しているアンチセンスはRelに対してしか効果がない、オフターゲット効果のない良いアンチセンスであることが確認できました。このように、従来のノックアウト法では遺伝子本来の機能が隠されてしまうため、以後の実験は、オフターゲット効果のない良いモルフォリノアンチセンスオリゴと特異的阻害剤を利用して解析を進めました。
図2. 遺伝的補償により隠されたRel/NFκBの機能
立場が逆転したWntとTLR-NFκB: 続いて、詳細なメカニズムの解析を進めました。脊椎動物の背腹軸を理解する上で、細胞外シグナルタンパク質Wntを無視することはできません。Wntは、Wnt/β-catenin経路と呼ばれる細胞内情報伝達経路を活性化する「古典的Wnt」と、それ以外の経路を制御する「非古典的Wnt」に分けることができます。これまでに、古典的Wntが将来背側になる領域でWnt/β-catenin経路を活性化することで背側オーガナイザーの形成が誘導されることがよく知られていました。一方で、非古典的Wntが背側オーガナイザー形成において古典的Wntの活動を抑制することも知られていました。しかし、非古典的Wntが古典的Wntを抑制するメカニズムはあまりよくわかっていませんでした。実は、石谷教授の博士論文はこの古典的Wntと非古典的Wntの関係に注目したものでしたが、当時のテクノロジーの限界で十分な解明はできていませんでした。その後、二十年、オーガナイザー以外の現象におけるWntについての研究を行ってきましたが、個人的には、博士論文研究にやや悔いを残していました。そこで、これまでに培ったWnt研究の知識と経験を総動員して、TLR-NFκB経路とWntの関連を解析しました。その結果、背側で古典的Wntによって活性化したWnt/β-catenin経路の下流で、非古典的Wnt(Wnt5)の発現が誘導され、Wnt5がTLR4(TLRファミリー受容体の一つ)に結合してTLR-NFκB(Rel)経路を活性化し、活性化したRelがFrzb(フリズビー)と呼ばれるタンパク質の発現を誘導すること、Frzbが細胞外で古典的Wntに結合して古典的Wntの活動を抑制することでオーガナイザーのサイズを適切に調節することがわかりました。つまり、昆虫ではTLR-NFκB経路の活動をWntが微調整することで背腹軸が誘導されるのに対し、脊椎動物ではWntの活動をTLR-NFκB経路が調節することで誘導されること、すなわち、WntとTLR-NFκBの立場が進化の過程で逆転したことを示しています。少なくとも、「Wntによる背側オーガナイザー形成」や「Frzb遺伝子」は脊椎動物のみならずナメクジウオ(頭索動物)やウニ(棘皮動物)にも存在し、昆虫には存在しないことから、これらの獲得によって立場逆転が起きたと推測されます。ただ、なぜ逆転させる必要があったのかは不明で、これについては今後の解析が待たれます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、動物発生メカニズムの無脊椎動物から脊椎動物への進化のプロセスに新たな理解と視点をもたらす重要な成果です。また、この研究には以下の二つの大きな価値、可能性があります。
① ノックアウト至上主義は危険である: 従来の生命科学研究において、遺伝子を破壊(ノックアウト)して機能を調べる方法は、最も強力で信頼性が高いと考えられてきました。しかし、本研究では、イメージング(可視化)を使ってありのままを観察し、遺伝的補償を回避できる遺伝子ノックダウン(機能阻害、アンチセンス)を使うことで、ノックアウトでは隠されて見えない重要な遺伝子機能を明らかにすることに成功しました。つまり、本成果は、遺伝子ノックアウト至上主義の生命科学研究に一石を投じるとともに、これまで遺伝子ノックアウト研究で見落とされてきた重要な生命現象を解き明かす道を切り拓くものでもあります。
② 細菌感染症と胚発生: 研究グループは「TLRが脊椎動物体軸形成に関わるという期待」を持って研究を進めていましたが、いざ期待通りにTLR4が体軸形成に関わると分かってみると、それとは別に気になることが出てきました。それは、TLR4は細菌感染に反応してNFκBを活性化する受容体である、ということです。実際、今回の研究の中で、ゼブラフィッシュの胚にLPS(グラム陰性菌の表面に存在する物質で、細菌感染の際にはTLR4はこれに反応する)を投与すると体軸形成が著しく妨害されることも判明しました。妊娠中の細菌感染は、自然流産、早産、死産、胎児の発生異常など、さまざまな異常を引き起こすことが知られていますが、その機序の理解はいまだに限定的です。今回の発見は、細菌感染症による胚発生異常のメカニズムの理解につながる可能性もあり、また今後、ゼブラフィッシュをモデルとした研究により、感染が胚発生に影響を与えるメカニズムについての理解がさらに深まることが期待されます。
特記事項
本研究成果は、ネイチャー姉妹誌「ネイチャーコミュニケーションズ」に11月8日(水)に公開されました。
タイトル:“Determining zebrafish dorsal organizer size by a negative feedback loop between canonical/non-canonical Wnts and Tlr4/NFκB”
著者名: Juqi Zou , Satoshi Anai , Satoshi Ota , Shizuka Ishitani , Masayuki Oginuma, Tohru Ishitani
なお、本研究は、科学研究費補助金(21H05287 、22H02820、20H05791、21J14254、23K18242)、セコム財団、公益財団法人 内藤記念科学振興財団、公益財団法人武田科学振興財団研究助成、公益財団法人 三菱財団、公益財団法人第一三共生命科学研究振興財団、公益財団法人 上原記念生命科学財団、公益財団法人 持田記念医学薬学振興財団などの支援を受け、実施されました。
参考URL
微生物病研究所生体統御分野
https://ishitani-lab.biken.osaka-u.ac.jp
用語説明
- Toll様受容体(TLR)-NFκB経路
1980年代にクリスティアーネ・ニュスライン=フォルハルトらがショウジョウバエの背腹軸の決定に異常を持つ変異体として、Toll(トル)とDorsal(ドーサル)などを発見し、その後、それらがそれぞれ受容体と転写因子をコードし、Toll受容体からのシグナルが転写因子Dorsalを活性化することでショウジョウバエの腹側が誘導されることがわかった。また、1986年にノーベル賞受賞者であるデビッド・ボルティモアらにより転写因子NFκBが発見され、のちにこれがDorsalの相同タンパク質(ホモログ)であることがわかった。さらに、1997年に哺乳類にもTollと類似のタンパク質群が存在することがわかり、Toll-like(Toll様)Receptor(TLR)と名付けられた。その後、TLRが種々の病原体を感知して転写因子NFκBなどを活性化させることで自然免疫を作動させる機能があることがわかった。現在、TLR-NFκB経路は自然免疫応答を担う重要な生命システムとして注目されており、一方で、当初から知られていた体軸誘導機能は徐々に注目されなくなっていった。
- 遺伝的補償
Genetic compensationという言葉でも知られる。細胞は環境を感知し、自身の遺伝子発現を微調整することにより環境に適応できる。この適応を担うのが遺伝的補償機構である。例えば、遺伝子ノックアウト動物の作製においては、まずはゲノム編集などでヘテロノックアウト個体を作製してそれを掛け合わせてホモ変異体を作製してから表現型解析を行うが、遺伝子が破壊されてから観察に至るまでに動物の世代交代を経るため、その間に細胞がその状態に適応するために遺伝子発現状態を変化させ、本来は野生型で働かない遺伝子が「破壊された遺伝子の機能」を補償してしまい、ホモ変異体で異常が生じなくなってしまうケースがある。一方で、アンチセンスや阻害剤を胚に投与してすぐに表現型を観察する場合は、補償機構が働く以前に観察ができるため、阻害された遺伝子の効果をよりクリアに見ることができる。2019年にディディエール・スタイナー博士らによってこの現象がクリアに説明されているので、ご興味のある方はぜひこちらを参考にしていただきたい(https://www.nature.com/articles/s41586-019-1064-z)。
- ゼブラフィッシュ
ヒマラヤ周辺の温帯地域の池の浅瀬や田んぼのそばに棲息するコイ科の淡水魚。胚や稚魚の体が小さく透明なため、イメージング解析に最も適したモデル脊椎動物であると考えられている。また、人と類似した遺伝子、細胞、臓器を有し、かつ、容易に飼育・実験操作できることなどから、「ヒト疾患研究の第3のモデル動物」として米国NIH(国立衛生研究所)に指定されている(第1、第2のモデルはマウスとラット)。
- Wnt
線虫、昆虫、魚類からヒトを含む哺乳類に至るまで高度に保存された細胞外情報伝達タンパク質であり、細胞表面の特定の受容体タンパク質に結合し、特定の細胞内情報伝達経路を活性化する。Wntという名前は、ショウジョウバエで発見された翅形成に関わる遺伝子winglessとマウスで見つかった乳がん遺伝子int-1が進化的に同じ遺伝子であることがわかり、二つの遺伝子名を組み合わせて名付けられた。現在では、Wntは体軸形成、幹細胞の誘導・維持、がんの発生など多様な機能を担うことが明らかにされている。また、Wntはその機能から古典的Wntと非古典的Wntに分類され、前者はWnt/β-catenin経路と呼ばれる細胞内情報伝達経路を活性化し、後者はそれ以外の経路を制御する。
- イメージング解析
生物の体内における細胞動態、細胞内の分子動態を可視化する研究方法。最も多くの情報を得ることができ、生命現象を最も効果的に理解できる方法の一つである。対象とする生物の透明度が高ければ体内深部までイメージングが可能で、かつ対象とする生物が小さければ分子動態、細胞動態、個体の変化を同時に把握できる。このため、小さく透明度の高い生物に対して極めて有効である。
- オーガナイザー
オーガナイザーは,ハンス・シュペーマン(Hans Spemann)とヒルデ・マンゴールド(Hilde Mangold)によって,イモリ胚を用いた原口背唇部の移植による二次胚誘導実験により見出された。シュペーマンはこの発見により、1935年にノーベル賞を受賞した。
- 負のフィードバック制御
情報伝達の流れが過剰にならないように、情報伝達の流れを自ら抑制する現象。多くの細胞内情報伝達経路において採用されている。本研究のケースでは、古典的Wntによるオーガナイザーの誘導(とそれに続く背側誘導)が過剰にならないようにこの制御が使われている。
- モルフォリノアンチセンスオリゴ(MO)
RNA、DNAのリボース、デオキシリボースの代わりにモルフォリン環を主鎖とするオリゴヌクレオチド。配列をデザインすることで、狙った遺伝子のmRNAと相補的に結合させることができ、mRNAの成熟あるいは翻訳を特異的に阻害することができる。受精卵や初期胚に打ち込むことで、任意の遺伝子の胚発生過程における機能を阻害することができる。
