細胞競合が臓器形成のしくじりを修正し、機能的な体を作り出す
運動機能発達と疾患予防における細胞競合の機能と、細胞競合マーカーFoxo3を発見
研究成果のポイント
概要
大阪大学微生物病研究所の石谷太教授(責任著者)、博士課程大学院生の松本かな子さん(筆頭著者)、龝枝佑紀助教(共筆頭著者)らの研究チームは、生命機能研究科佐々木洋教授らとの共同研究により、細胞競合と呼ばれる免疫細胞を介さない不良細胞排除機構が、神経細胞や筋肉細胞をミスなく正確に配置し、機能的で病気になりにくい健康体を作り出すために必須の役割を果たすことを明らかにしました(図1)。さらに、世界で初めて脊椎動物の細胞競合のマーカーの同定に成功しました。
動物のからだは、ゲノム・エピゲノムにプログラムされた設計図に基づいて作り上げられます。しかし、近年の研究により、からだづくりの過程で、設計図通りに動作しない(あるいは動作できない)不良な細胞が頻繁に生じてしまうことが明らかになりつつあります。石谷教授らは以前に、生きた組織の細胞や分子の動態を観察するイメージング解析に適したモデル脊椎動物ゼブラフィッシュを用いて、胚 (初期段階の赤ちゃん)のからだづくりの過程において生じた不良な細胞が細胞競合と呼ばれる細胞間コミュニケーション機構によって排除されることで胚発生のエラーを防いでいることを明らかにしてきました(参考:2019年プレスリリース・2024年プレスリリース)。しかしながら、胚発生以降のからだづくりのプロセスで細胞競合が働いているかはよくわかっていませんでした。また、生体内で突発的かつ不規則に生じる不良細胞とその排除過程を観察するのは至難の業であり、細胞競合を捕捉するためのマーカー分子の同定が求められていました。
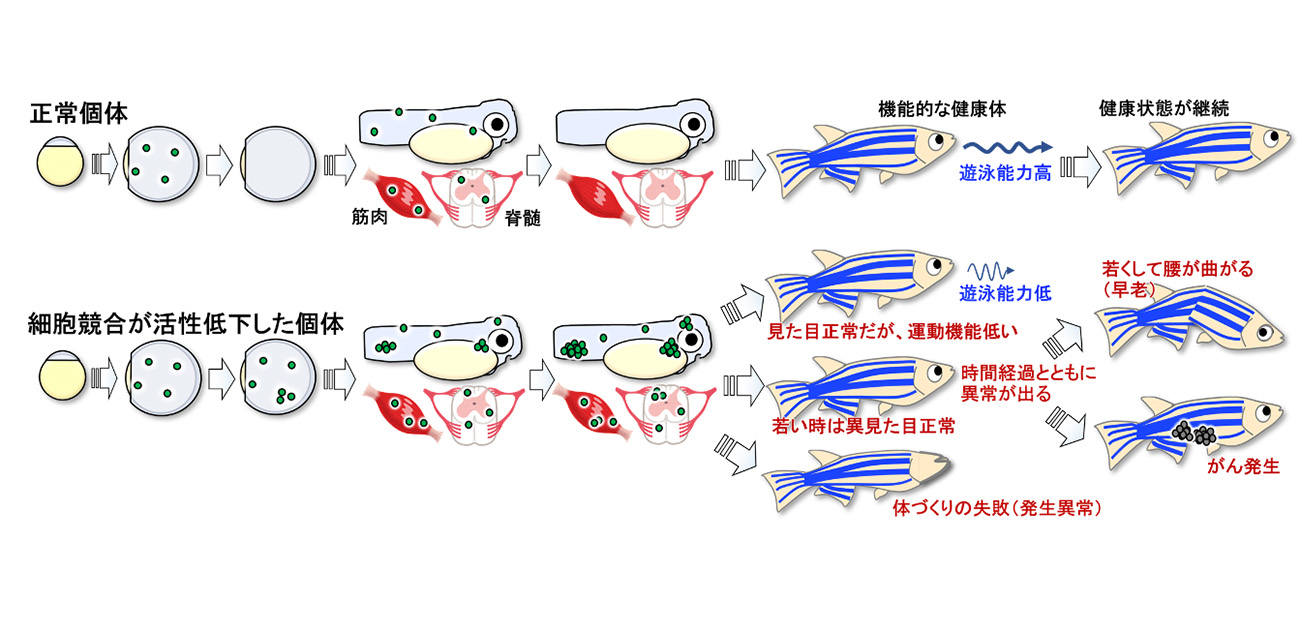
今回、研究チームは、ゼブラフィッシュを用いた解析により、脊髄や筋肉が作られるプロセスにおいてプログラムが正常に作動しない不良細胞が頻繁に生じることを発見し、さらに、これらの不良細胞が細胞競合によって取り除かれることを明らかにしました(図1)。続いて、細胞競合の抑制実験により、細胞競合が速筋・遅筋細胞や脊髄内の神経細胞の正確な配置、運動機能の発達、将来的な腫瘍などの病気の抑制など、老化しにくい健康な体の構築に必須であることを示しました(図1)。
また、ゼブラフィッシュの胚や形成中の脊髄や筋肉、マウス胚における細胞競合において共通して活性化する因子として転写因子Foxo3を同定し、さらに、Foxo3が脊椎動物共通の細胞競合マーカーであることを明らかにしました。細胞競合は、その不良細胞排除能力から「新たな生体防御機構」として近年注目されつつありますが、マーカーがないためにその生理機能の探索がこれまで極めて困難でした。しかし、今回の研究で細胞競合マーカーが同定されたことにより、機能探索が容易になり、今後、細胞競合の新たな未知機能が一気に明らかになる可能性が拓けました。また、ヒトにおいてFoxo3遺伝子の活性と長寿や知能、体型などとの関連が知られており、細胞競合が個体の一生涯において多様な機能を果たしている可能性が期待できます。
本研究成果は、Nature姉妹誌「Nature Communications」に掲載され、2024 年 12 月17日に公開されました。
図1. 生理的細胞競合は臓器形成のエラーを防ぎ、機能的な健康体を作り出す
研究の背景
動物はからだづくりのプロセスはエラーだらけ:
ヒトを含む動物のからだは、たった一つの受精卵が分裂増殖することで作り上げられた細胞が、特定の機能を獲得(分化)し、特定の位置に配置することで作り上げられます。こうした細胞の増殖・分化・配置は、ゲノム・エピゲノムにプログラムされた設計図に基づいて作り上げられます。
近年の研究により、からだづくりの過程で、設計図通りに動作できない不良細胞や細胞機能に異常が生じた病的細胞がしばしば生じてしまうことが明らかになりつつあります。例えば、研究グループは、ゼブラフィッシュ胚においてWntシグナル(特定の細胞の数と配置を規定する信号)を正常に動作できない細胞が頻繁に生じることを報告しました(Akieda et al., Nature Commun 2019, 2019年プレスリリース)。また、マウス胚において多能性(からだを構成する多様な細胞を作り出す能力)が低い細胞やミトコンドリアに異常が生じた細胞が出現すること(Hashimoto & Sasaki Dev Cell 2019; Lima et al. Nature Metabolism 2021)が報告されました。さらに、ヒト着床前胚の73%、野生型マウス着床前胚の25%において異数性細胞(染色体数が異常な細胞=設計図が異常な細胞)が生じているという報告もあります(van Echten-Arends et al. Hum Reprod Update 2011; Lightfoot et al., Dev Biol 2006)。この事実は、動物のからだづくりは意外にも正確性が高くなく、エラーが起きまくっていることを意味します。
ところが、興味深いことに、動物胚はこのようなエラーを繰り返すにも関わらず、最終的に健康で機能的なからだを作り上げることができます。しかしながら、どのようにしてこのようなエラーを乗り越えるのかは、よくわかっていませんでした。
細胞競合が胚のエラーを取り除く:
細胞競合は、「同種の細胞集団内に生じた“異質な細胞”が隣接細胞との相互作用を介して選択的に排除される現象」です。この現象は、ショウジョウバエの上皮組織に人為的に誘導したリボソーム遺伝子異常細胞が正常細胞とのコミュニケーションを経て排除される現象として、約50年前に発見されました(Morata & Ripoll, Dev Biol 1975)。その後、哺乳類においても同様の現象が起こることがわかり、ショウジョウバエや哺乳類培養細胞を用いたメカニズム解明が進められてきました。また、発がんシグナル(がんの発生を誘導する信号)が活性化した細胞が細胞競合によって排除されることもわかり、細胞競合は新たながん抑制機構ではないか、と、期待されるようにもなりました。
しかしながら、細胞競合が脊椎動物のからだの中でどんな役割(生理的機能)を果たしているのかは、全く不明なままでした。そのため、「細胞競合はあくまで人為的に異常な細胞を細胞集団に導入したときに見られる人工的な生命現象であり、実際の動物のからだの中では生理的な機能を持たないのではないか」、「生き物の中で自然に起こる細胞競合をとらえなければ意味がない」という批判的な意見もありました。
そのような中、研究グループは5年前に、ライブイメージングに適したモデル脊椎動物であるゼブラフィッシュをモデルとした解析により、胚において自然発生した不良細胞が「細胞競合」を介して排除されることを世界に先駆けて発見しました。具体的には、ゼブラフィッシュ胚においてプログラムから外れた異常なWntシグナル活性を持つ不良細胞が生じると、不良細胞のWntシグナル異常が細胞膜上のカドヘリンタンパク質の量的異常に変換されることで隣接正常細胞が不良細胞の出現を感知し、細胞死を誘導することを明らかにしました(図2; Nature Commun 2019; Science Adv 2024)。
また、同時期に、生命機能研究科の佐々木教授(本研究の共同研究者)らによって、マウス胚に生じた多能性が低い細胞も隣接細胞との細胞競合によって胚から排除されることが報告され(Hashimoto & Sasaki Dev Cell 2019)、さらにイギリスの研究チームによって、マウス胚に生じたミトコンドリア異常細胞も正常細胞との細胞競合によって排除されることが示されました(Lima et al. Nature Metabolism 2021)。つまり、これらの発見により、動物胚がエラーを克服する仕組みの一端が明らかになっただけでなく、細胞競合の生理的機能も初めて明らかになったわけです。
続く大きな課題:
しかし、臓器の構築などの動物のからだづくりの後期プロセスにおいても細胞競合がエラー修復を担っているのかは全く不明です。例えば、運動能力を持った動物個体を作り上げるためには、正しい位置に一定数の筋肉細胞を作り、さらにそれらを制御する運動神経細胞やそれとネットワークを作る介在神経細胞も適切な位置に配置する必要があります。こうした臓器構築における精緻な細胞数の制御、細胞配置の実現に細胞競合が貢献しているかは不明です。また、細胞競合は生体内で突発的かつ不規則に生じる不良細胞と隣接細胞のコミュニケーションであり、このことが生理的な細胞競合の理解を阻んできました。
今後、生体内における細胞競合の機能を理解していくためには、脊椎動物体内で起こる生理的細胞競合を捕捉するためのマーカー分子が有効なツールになるのは間違いありませんが、そのようなマーカー分子はこれまでに見つかっていませんでした。とはいえ、細胞競合は多様な異常性(Wntシグナル異常、多能性低下、ミトコンドリア機能異常、リボソーム遺伝子異常、発がんシグナル活性化など)によって起動されるため、それを感知・排除するメカニズムも多様であり、全ての細胞競合を捕捉できるような分子を見つけることは不可能に近い、とも考えられてきました。
図2. Wintシグナル以上細胞の細胞競合を介した感知・排除
Wintシグナル活性が高い細胞は細胞膜上のカドヘリン量が多く、活性が低い細胞ではカドヘリン量が少ない。突発的に生じたWntシグナル異常細胞では膜カドヘリン量が変化し、結果、隣接正常細胞群に感知され細胞死が誘導される
研究の内容と成果
発見1)細胞競合は運動機能の発達に必須である:
石谷教授らは、5年前に報告した研究では、胚において特定の細胞の数と配置を規定するWntシグナルに注目し、その活動にエラーが生じた細胞が細胞競合により排除されることを示していました(図2;Akieda et al., Nature Commun 2019)。そこで、今回の研究では、筋肉と脊髄の形成過程において細胞の数と配置を規定するShhシグナルに注目しました。Shhシグナルは、形成過程の脊髄においては、その入力強度に応じて異なるタイプの運動神経細胞と介在神経細胞を作り出します。また、魚類の筋肉においては、強いShhシグナルが入力されると遅筋細胞が形成され、Shhシグナルの入力が弱いと速筋細胞が誘導されます。つまり、適切な位置で適切な強度でShhシグナルが活動することにより機能的な脊髄と筋肉が形成されます。まず、石谷教授らは、Shhシグナルの活動をゼブラフィッシュにおいて可視化しました。その結果、筋肉と脊髄の形成過程において本来Shhシグナルの活性が低く抑えられるべき領域でShhシグナルが異常に活性化した細胞が生じたり、逆にShhシグナルが強く活性化される領域でShhシグナルが活性化しない細胞が生じてしまうこと(筋肉と脊髄を作る細胞集団がしょっちゅうしくじりをしでかすこと)がわかってきました(図3中段)。
また、メカニズム解析の結果、Wntシグナル異常細胞のケースと似ているが少し異なる機構によってShhシグナル異常細胞が排除されることがわかってきました。まず、Shhシグナルがその強度に応じて細胞膜のカドヘリン量を減らすため(Wntシグナルはカドヘリン量を増やす)、結果として、Shhシグナル活性が高い領域では細胞膜上のカドヘリン量が少なく、活性が低い領域ではカドヘリン量が多くなることがわかりました(図3上段)。その結果、突発的に生じたShhシグナル異常細胞ではカドヘリン量が変化し(図3中段)、この変化を隣接正常細胞が感知し、異常細胞を殺す(図3下段)ことを発見しました。
また、筋肉や脊髄が形成される時期に細胞競合を強制的に抑制すると、脊髄内において運動神経細胞や介在神経細胞が間違った場所に配置され、筋肉においても速筋・遅筋細胞の配置が乱れ、その後、成長した稚魚における遊泳能力が低下しました(図1)。すなわち、生理的な細胞競合が速筋・遅筋細胞や脊髄内の神経細胞の正確な配置、運動機能の発達に必須であることが明らかになりました(図1)。
発見2)Foxo3は細胞競合の共通制御因子である:
続いて、Wntシグナル異常細胞とShhシグナル異常細胞の排除メカニズムの共通機構を探っていきました。共通機構がわかれば、マーカーの発見につながると期待したためです。その結果、いずれの異常細胞の排除においても、カドヘリン量変化の下流で異常細胞内の転写因子Smadと転写因子Foxo3が活性化し、SmadとFoxo3が協調して更なるFoxo3遺伝子の発現増加を促し、その結果として活性酸素ROSの誘導と細胞死抑制因子Bcl2の減少が起こることで異常細胞がアポトーシスを起こすことがわかってきました。
また、Foxo3の活性化は異常細胞の排除に必須であり、Foxo3を機能阻害したゼブラフィッシュでは、胚や筋肉・脊髄において自然発生して生じたWntシグナル異常細胞やShhシグナル異常細胞が蓄積し、細胞配置が乱れました。こうした胚と臓器における細胞配置異常の結果として、稚魚に成長後、一部のFoxo3抑制個体は発生異常(目が欠損したり尻尾が曲がったり体長が短かったり)を示し、また別のFoxo3抑制個体は、見た目正常にも関わらず遊泳能力が低かったり、時間の経過とともに腰が曲がったり腫瘍ができたりなど早老様の異常を示したりしました(図1)。これは、体内に生じた不良細胞・病的細胞が時間の経過とともに増加したり病的効果を発揮したりしたことによって生じたと考えられます。
発見3)Foxo3は細胞競合の共通マーカーである:
Foxo3は、自然発生したWntシグナル異常細胞ならびにShhシグナル異常細胞において強く発現していました。この発見を受け、Foxo3が細胞競合の共通マーカーになる可能性を期待し、その可能性を検討しました。その結果、ゼブラフィッシュに生じたWnt/Shhシグナル異常細胞のみならず、リボソーム遺伝子異常細胞や発がんシグナル活性化細胞など細胞競合において排除される不良細胞・病的細胞においてそれらが排除される前にFoxo3が発現誘導されることを見出しました。また、生命機能研究科佐々木教授との共同研究により、マウス胚においても、細胞競合で排除される多能性低下細胞やミトコンドリア機能異常細胞でFoxo3の発現上昇が確認されました。これらの事実は、Foxo3が哺乳類や魚類を含む脊椎動物において共通して使える細胞競合マーカーであることを示唆します。そこで、Foxo3の発現を高感度に検出できる組換えゼブラフィッシュを作製し、発生プロセスにおけるFoxo3の発現動態を観察したところ、胚や筋肉・脊髄においてランダムにFoxo3発現細胞が出現し、アポトーシスを起こして消えていく様子を捉えることができました。この事実は、今まで、いつどこで起こるかさっぱりわからなかった細胞競合の活動をFoxo3の発現を指標に捕捉できる可能性を示しています。
図3. Shhシグナル異常細胞の細胞競合を介した感知・削除
本研究の意義と発展性
細胞競合を生理的なエラー修復機構として再定義:
上述のように、つい最近まで、細胞競合は人工的にしか観察できておらず、細胞競合が生理的環境で機能する生命現象なのかさえも不明でした。そのような中、石谷教授のチームは世界に先駆けて脊椎動物胚における生理的細胞競合(自然発生したWntシグナル異常細胞の排除)の捕捉に成功しましたが(Nature Commun 2019)、胚以外でも生理的細胞競合が起こるのかや、その競合がどのような生理的意味をもつのかは理解がほとんど進んでいませんでした。
今回の研究により、形成過程の脊髄や筋肉で生じるエラーの修復に生理的細胞競合が起こることを示しました。また、生理的細胞競合が運動器形成や運動機能発達、病気になりにくいからだの構築に必須であることが明らかになったことで、細胞競合が生理的に機能するエラー修復機構であることを明確に定義できました。生理的に重要な生命現象であることが明確になったことで、今後、多くの研究者が細胞競合に興味を持ち、この分野が一層盛り上がることが期待されます。
不良細胞発生と細胞競合の動態把握、細胞競合の未知機能探索が可能に:
不良細胞は不規則に生じるため、結果として、それが生体内のどこにいつ生じるのか、そしてそれが駆動する細胞競合がいつどこで起こるのかは、これまでは捕捉困難でした。しかし、今回の研究で細胞競合の共通マーカー(細胞競合によって排除される不良細胞・病的細胞で共通して発現する因子)としてFoxo3を発見したことにより、脊椎動物における生理的細胞競合の研究が一気に前に進める道が拓けました。マーカーを利用することで、動物の発生、成長、恒常性維持、老化の一生涯のプロセスにおいて、いつ、どこで細胞競合が起こるのかを探ることができます。また、どのような異常が細胞競合を起動するのか、細胞競合がどのような異常を排除することで正常な個体構築や維持、病気の抑制を支えているのかも調べることができます。Foxo3は魚とマウス双方の細胞競合を捕捉できるため、おそらくヒトを含むその他の動物でもマーカーとして使用できる可能性が高いと考えています。加えて、本研究では、Foxo3以外にも細胞競合マーカー候補を複数見つけており、これらを同時に利用することでより正確に細胞競合の動態を探ることができるでしょう。
近年、アルツハイマー病や、てんかん、自閉症、糖尿病などの多様な疾患が、胚発生期に生じた変異細胞が生存・増殖して体細胞モザイクを形成することで引き起こされることが明らかになりつつあります(Beck et al., Hum Mol Genet 2004; Bonnefond et al., Nature Gent 2013; Wei et al., Genet Med 2019など)。この事実は、これらの変異細胞が細胞競合によって排除されずに生存・増殖した可能性を示しています。しかし、細胞競合の破綻の結果として変異細胞が生存したのか、あるいは変異細胞が細胞競合に耐性を持っているのかは不明です。今後、胚発生時に生じた変異細胞に起因する多様な疾患の発症と細胞競合の関連を、マーカーを利用して調べることで、疾患発症の新しい原理が理解できるようになると期待しています。
また、今回の研究により、細胞競合の活性が個体差に関連する可能性も見えてきました。不良細胞は、不規則に生じるため、細胞競合を抑制した個体は、個体ごとに異なる時期から異なる部位に異なるタイプの不良細胞が蓄積し、それを内包しつつ成長します。結果として、細胞競合抑制個体は、個体ごとに異なったバリエーション豊かな異常、機能低下の表現型を示します。例えば、体長が短い個体、運動能力が低い個体、若齢の時は外見正常なのに加齢に伴って形態に異常が生じる個体など、個体ごとに多種多様な表現型を示します。関連し、Foxo3遺伝子がヒトの多様な個人差に関連する可能性が示唆されています。具体的には、Foxo3の遺伝子配列の違い(遺伝子多型)が、身長差(Yengo et al., Nature 2022)、知能の差(Sniekers et al., Nature Genet 2017)、寿命の長さ(Deelen et al., Nature Commun 2019)など多様な個体差と関連することがわかってきています。もしかしましたら、動物の一生涯における細胞競合の機能を調べていくことで、こうした個体差が生じるメカニズムの理解にも繋げていけるかもしれません。
がんの抑制メカニズムとして:
ヒトの成体において生じたShhシグナル異常活性化細胞は、基底細胞癌や髄芽腫、膠芽腫など、様々ながんの原因となることがよく知られています(Villavicencio et al., AJHG 2000など)。今回の研究により、動物組織がShhシグナルに異常を持つ細胞を免疫細胞に頼らずに細胞競合により排除できることが明らかになりました。したがって、同様のメカニズムがヒト成体でも機能し、がんの発生を未然に防いでいる可能性が期待できます。興味深いことに、Shhシグナル異常細胞の排除に関わるSmad(Smad2/3/4)とFoxo3はいずれも「がん抑制遺伝子(機能低下するとがん発症が促される遺伝子)」として知られています。SmadとFoxo3の機能低下はShhシグナル異常細胞の生存を促すことから、細胞競合によるShh異常細胞(前がん細胞)排除がSmadとFoxo3のがん抑制機能の一つと考えることもできます。このように、今回発見した現象を起点に、新たながん抑制メカニズムの理解にも繋げていける可能性が大いにあります。
特記事項
本研究成果は、Nature姉妹氏「Nature Communications」に12月17日(火)19時(日本時間)に公開されました。
タイトル:“Foxo3-mediated physiological cell competition ensures robust tissue patterning throughout vertebrate development”
著者名: Kanako Matsumoto(共第一著者), Yuki Akieda(共第一著者), Yukinari Haraoka, Naoki Hirono, Hiroshi Sasaki, Tohru Ishitani(責任著者)
なお、科学研究費補助金(24KJ16170、21H05287、21H05288、22H02820、23K18242、22H04845、21K15085、JPMXP1323015484)、AMED-CREST (24gm2010001h0001)、セコム科学技術財団、公益財団法人武田科学振興財団、公益財団法人コーセーコスメトロジー研究財団、アステラス病態代謝研究会などの支援を受け、実施されました。
参考URL
微生物病研究所生体統御分野
https://ishitani-lab.biken.osaka-u.ac.jp
用語説明
- 不良細胞
機能が破綻した細胞、あるいは、場に不適応で組織機能に負の影響を及ぼしうる細胞。これまでの研究で、細胞競合がWntシグナル異常、多能性低下、ミトコンドリア機能異常、リボソーム遺伝子異常、発がんシグナル活性化などの異常を持った不良細胞を排除することがわかっていたが、本研究により、Shhシグナル(筋肉や運動神経細胞の種類や位置を規定する信号)に異常を持つ不良細胞も細胞競合によって排除されることがわかった。
- 細胞競合
同種の細胞集団内に生じた“異質な細胞”が隣接細胞との相互作用を介して選択的に排除される現象。1975年に、リボソーム遺伝子変異細胞をショウジョウバエ組織に人為的に導入すると正常細胞とのコミュニケーションを経て排除される現象として最初に発見された (Morata & Ripoll Dev Biol 1975)。その後、ショウジョウバエや哺乳類培養上皮をモデルとして「人為的に誘導した不良細胞(発がんシグナルが活性化した細胞など)と正常細胞の細胞競合」を対象としたメカニズム解析が進められてきたが、細胞競合は人工的にしか観察できておらず、細胞競合が生理的環境で機能する生命現象なのかさえも不明であった。しかし、石谷教授らの研究グループの研究によって、発生プログラムのエラー修復という細胞競合の生理的役割が明らかになりつつある。
- マーカー
正式には、分子バイオマーカーあるいは細胞バイオマーカーという。組織や体液における特定の分子・細胞の有無、あるいは存在量を指標として、任意の疾患の診断や予後、予測、薬品の安全性・毒性などに利用する。今回の細胞競合マーカーFoxo3を利用することで、その発現量が周辺細胞と比較して不規則に高い細胞を「細胞競合が起きている細胞の候補」としてみなすことができる。
- イメージング解析
生物の体内における細胞動態、細胞内の分子動態を可視化する研究方法。最も多くの情報を得ることができ、生命現象を最も効果的に理解できる方法の一つである。対象とする生物の透明度が高ければ体内深部までイメージングが可能で、かつ対象とする生物が小さければ分子動態、細胞動態、個体の変化を同時に把握できる。このため、小さく透明度の高い生物に対して極めて有効である。マウスなど大きな動物で行う場合は、臓器を取り出したりレンズを体内に入れたり、あるいは動物を殺して固定し透明化などの処理を施す必要がある。
- ゼブラフィッシュ
ヒマラヤ周辺の温帯地域の池の浅瀬や田んぼのそばに棲息するコイ科の淡水魚。胚発生が早く(受精から基本的な体が出来上がるまで24時間程度)、胚が小さく透明なため、イメージング解析に最も適したモデル脊椎動物であると考えられている。また、人と類似した遺伝子、細胞、臓器を有し、かつ、容易に飼育・実験操作できることなどから、「ヒト疾患研究の第3のモデル動物」として米国NIH(国立衛生研究所)に指定されている(第1、第2のモデルはマウスとラット)。本国では同サイズの小型魚類としてメダカが有名であり、近年の研究論文数や研究者人口はゼブラフィッシュの方が圧倒的に多いにも関わらず、よく混同される。メダカが遺伝学解析に適しているのに対してゼブラフィッシュは胚を用いた解析などに適しており、研究用途が異なる。どちらも優れた実験動物である。
- 胚
多細胞生物が受精卵から細胞分裂を繰り返しながら成長する初期段階の状態を指します。赤ちゃんとして成長するための最初のステップ。
- 2019年プレスリリース
組織・臓器の発生プロセスのエラー回避機構を発見-がんや先天性疾患などの発症機構理解に新たな視点-
https://resou.osaka-u.ac.jp/ja/research/2019/20191017_1
2019年10月 Nature Communications掲載研究成果
タイトル:“Cell competition corrects noisy Wnt morphogen gradients to achieve robust patterning”
著者名:Yuki Akieda, Shohei Ogamino, Hironobu Furuie, Shizuka Ishitani, Ryutaro Akiyoshi, Jumpei Nogami, Takamasa Masuda, Nobuyuki Shimizu, Yasuyuki Ohkawa, & Tohru Ishitani
- 2024年プレスリリース
細胞社会の秩序は、フォースによって守られるー細胞集団が細胞間張力を使って「秩序を乱す不良な細胞」を感知・排除することを発見―
https://resou.osaka-u.ac.jp/ja/research/2024/20241119_3
2024年11月Science Advances掲載研究成果
タイトル:“Mechano-gradients drive morphogen-noise correction to ensure robust patterning”
著者名: Kana Aoki, Taiki Higuchi, Yuki Akieda, Kotone Matsubara, Yasuyuki Ohkawa, Tohru Ishitani
