脳の形成に重要なタンパク質の機能を解明
中枢神経系組織形成における細胞内タンパク質輸送制御分子の役割
研究成果のポイント
- 神経前駆細胞は細胞内成分が非対称に分布することで形成される細胞極性を持っており、この極性の形成に重要な細胞同士の接着に関わる分子が細胞膜へ運ばれるメカニズムを明らかにした。
- 神経前駆細胞は細胞同士が接着することが細胞の形態形成や増殖、神経細胞への分化、組織構築に重要であることが知られていたが、どのように神経前駆細胞の接着部位へ輸送され、局在化しているかは不明であった。
- 神経前駆細胞の接着異常によって生じる水頭症や、小脳の欠損が生じるダンディー・ウォーカー症候群といった疾患の病態解明への貢献が期待される。
概要
大阪大学大学院医学系研究科の國井政孝助教、原田彰宏教授(細胞生物学)らの研究グループは、細胞内においてタンパク質の輸送を制御するタンパク質SNAP23(synaptosomal-associated protein 23)が、神経前駆細胞で細胞間接着に関わる分子であるN-cadherinの細胞膜への局在化を促進し、大脳皮質や小脳の形成に重要な役割を担っていることを明らかにしました。
発生中の脳において、N-cadherinによる神経前駆細胞同士の接着は、細胞の極性形成に重要であり、正常な極性は細胞増殖や神経細胞への分化、神経細胞の層形成に重要であることが知られています。しかしながら、N-cadherinが細胞内でどのように輸送され、細胞膜の一部の領域へ局在化するのかは分かっていませんでした。
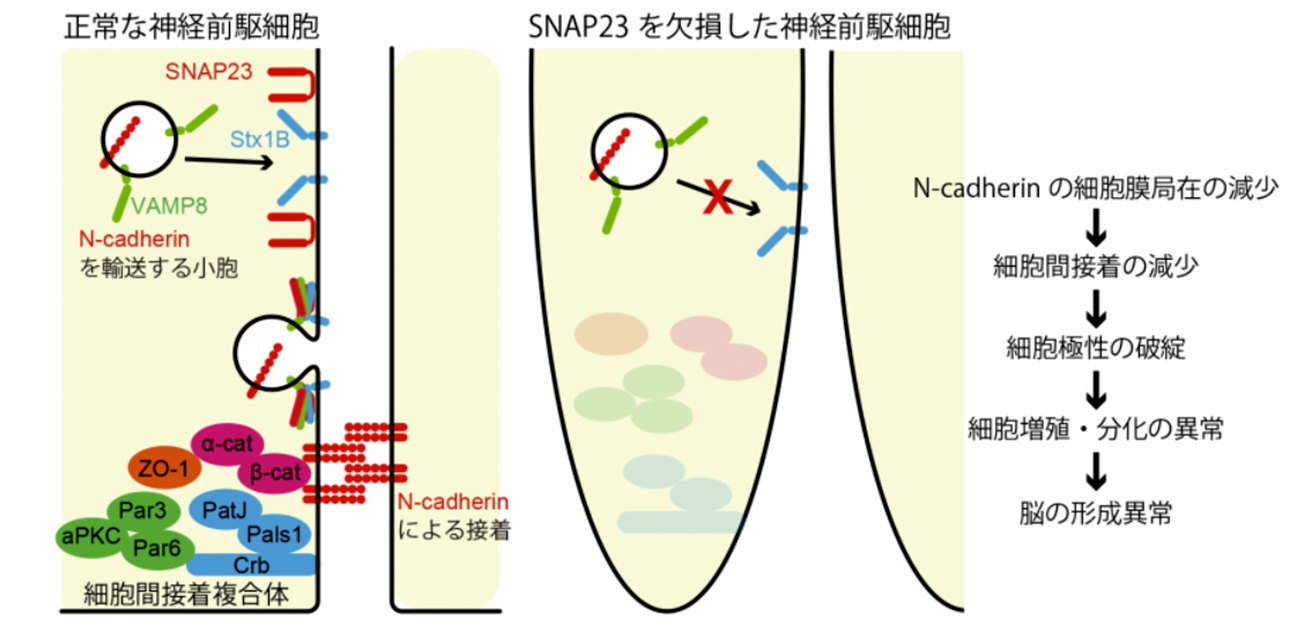
今回、研究グループは、細胞内のタンパク質輸送において細胞膜への膜タンパク質の局在化を制御するSNAREタンパク質に注目し、その一つであるSNAP23の機能解析を行いました。中枢神経系の組織で特異的にSNAP23を欠損したマウスでは、大脳皮質の低形成や小脳の欠損といった重篤な組織形成異常が生じました。さらに詳細に解析した結果、SNAP23は他のSNAREタンパク質であるSyntaxin1B、VAMP8と共にN-cadherinを神経前駆細胞の細胞間接着部位へと局在化させるのに機能していることを解明しました(図1)。これにより、水頭症やダンディー・ウォーカー症候群といった、脳の形成不全を生じる疾患の病態解明につながることが期待されます。本研究成果は、米国科学誌「The Journal of Cell Biology」に、12月18日(金)(日本時間)に公開されました。
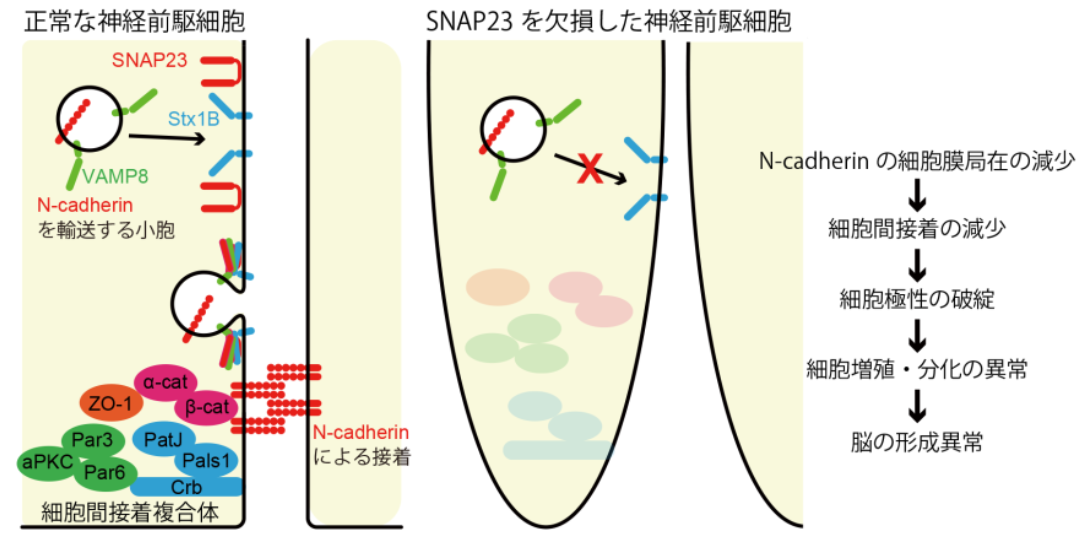
図1 SNAP23によるN-cadherin輸送の概略図 神経前駆細胞において、SNAP23はVAMP8, Syntaxin1B (Stx1B)といったSNAREタンパク質と結合することでN-cadherinを細胞間接着部位の細胞膜へと局在化させる。SNAP23欠損マウスではN-cadherinの細胞膜への局在化が減少することで細胞間接着が減少し、神経前駆細胞の極性が失われる。このことが細胞増殖や分化の異常へとつながり、正常な脳の形ができなくなると考えられる。
研究の背景
脳は人体の中でも特に複雑な構造を持つ臓器ですが、その構造が正常に作られるためには、脳を構成する一つ一つの細胞が正常な形態をとって正確な位置へ配置されることが重要です。発生中の脳では神経細胞やグリア細胞を産み出す神経前駆細胞が重要な働きをしています。神経前駆細胞は細胞体から脳室側(脳の内側)および脳軟膜側(脳の外側)へ向かって長い突起を伸ばす特徴的な形態を持った極性細胞ですが、この極性がどのように形成されるのかといったことはよくわかっていませんでした。今回、研究グループは、細胞内でタンパク質を一定の方向へ輸送する極性輸送において、膜タンパク質の細胞膜への局在化を制御するSNAREタンパク質SNAP23に注目しました。
SNAP23は全身の様々な組織に発現し、ホルモンや酵素の分泌などに重要な働きをしていることが報告されていますが、脳における機能は知られていませんでした。
本研究の成果
研究グループは、中枢神経系組織で特異的にSNAP23遺伝子を欠損したマウスを作成し、脳の形成におけるSNAP23の働きを調べました。SNAP23欠損マウスは出生しましたが、成長遅延や運動機能障害が認められ、生後3週程度で死亡しました。その脳の構造を観察すると、大脳皮質は著しく小さく、小脳に至ってはほぼ完全に失われていました(図2)。研究グループはマウス胎児の発生中の脳組織をさらに詳しく解析し、SNAP23欠損マウスの脳では神経前駆細胞の細胞同士の接着が無くなっており、細胞の極性が失われて突起が伸びない異常な形の細胞ができていることを発見しました。また、この神経前駆細胞の形態異常が細胞増殖や神経細胞の産生異常、細胞死につながっていることを示唆する結果を得ました。
神経前駆細胞の接着には、N-cadherinといった細胞間の接着を担う分子が関わっていることが知られています。そのため、SNAP23欠損マウスにおけるN-cadherinの局在を調べたところ、SNAP23欠損マウスの神経前駆細胞ではN-cadherinが細胞膜へ局在化していないことがわかりました。さらに詳しく解析を行い、神経前駆細胞におけるN-cadherinの輸送と接着部位の細胞膜への局在化はSNAP23とそのパートナータンパク質であるVAMP8、Syntaxin1Bによって促進されていることを明らかにしました(図2)。
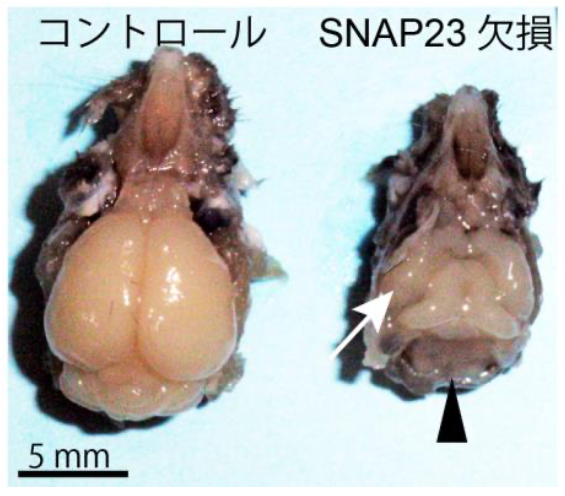
図2 2週令マウスの脳の形態 SNAP23欠損マウスはコントロールマウスに比べ大脳皮質が小さく(矢印)、小脳はほとんど失われていた(矢頭)
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、神経前駆細胞内におけるタンパク質の極性輸送が細胞の極性形成に重要な役割を果たしていることが世界で初めて示されました。さらに、個体レベルの解析を行うことで、神経前駆細胞の極性形成が正常な神経発生や脳の形成に重要であることも示されました。これらの成果によって、今後、水頭症やダンディー・ウォーカー症候群といった、脳の形成不全を生じる疾患の病態解明や治療法の開発につながることが期待されます。
特記事項
本研究成果は、2020年12月18日(金)に米国科学誌「The Journal of Cell Biology」(オンライン)に掲載されました。
【タイトル】 “SNAP23 deficiency causes severe brain dysplasia through the loss of radial glial cell polarity”
【著者名】 Masataka Kunii1, Yuria Noguchi1, Shin-ichiro Yoshimura1, Satoshi Kanda1, Tomohiko Iwano2, Erda Avriyanti3, Nur Atik4, Takashi Sato6, Ken Sato6, Masaharu Ogawa7, and Akihiro Harada1* (*責任著者)
【所属】
- 大阪大学 大学院医学系研究科 細胞生物学
- 山梨大学 大学院総合研究部 医学域 解剖学講座細胞生物学教室
- Padjadjaran大学 Department of Dermatology and Venereology, Faculty of Medicine
- Padjadjaran大学 Department of Biomedical Sciences, Faculty of Medicine
- 群馬大学 生体調節研究所 分子糖代謝制御分野
- 群馬大学 生体調節研究所 細胞構造分野
- 理化学研究所 脳神経科学研究センター
なお、本研究は、科学研究費補助金の基盤研究B(18H02594)および若手研究B(17K17847)、新学術領域研究「細胞機能を司るオルガネラ・ゾーンの解読」(17H06422)の支援を得て行われました。
参考URL
医学系研究科 原田研究室HP
https://www.harada-lab.online/
用語説明
- 細胞極性
組織を構成する種々の細胞はそれぞれ特徴的な形を持っており、細胞の方向性を細胞極性という。例えば、神経細胞は軸索と樹状突起、上皮細胞は頂端側と側底側という極性を持っており、組織構築や生理機能に重要である。細胞極性の破綻はがんなどの疾患につながることも知られている。
- SNAP23 (synaptosomal-associated protein 23)
主に細胞膜に局在するSNAREタンパク質の一つ。全身の様々な細胞に発現しており、膜タンパク質の細胞膜への局在化や分泌タンパク質の細胞外への放出に関与している。
- N-cadherin
Cadherinは細胞と細胞を接着させる機能を持つタンパク質分子であり、アドヘレンスジャンクション(接着帯)と呼ばれる接着部位を形成する。竹市雅俊博士によって発見された。N-cadherinは特に神経前駆細胞の細胞間接着に関わる。
- SNARE (Soluble N-ethylmaleimide sensitive factor attachment protein receptor)タンパク質
細胞内極性輸送において輸送小胞と細胞内小器官、細胞膜との融合を促進するタンパク質群。細胞膜との融合にはVAMP・Syntaxin・SNAPの3分子が結合することで促進される。
