免疫の初期防御応答における閾値(いきち)機構の解明
速やかな抗原応答のメカニズムをオミクスデータと数理モデルで説明
研究成果のポイント
・免疫B細胞 は抗原暴露1時間後に速やかに免疫関連遺伝子の発現誘導を行う
・急激に発現が増大する遺伝子(閾値応答遺伝子)にはNF-kB転写因子 が関与する
・エンハンサー と呼ばれるDNA領域へのNF-kB結合数が遺伝子発現の量を決定することをオミクスデータ解析 と数理モデル により解明
概要
大阪大学大学院理学研究科の大学院生道田大貴さん(博士前期課程)らをはじめとする大阪大学蛋白質研究所細胞システム研究室(岡田眞里子教授)の研究グループは、免疫B細胞の速やかな抗原応答の分子メカニズムをオミクスデータと数理モデルを用いて明らかにしました。これは、理化学研究所生命医科学研究センター、同・生命機能科学研究センター、東京医科⻭科大学難治疾患研究所(二階堂愛教授)、東京大学大学院新領域創成科学研究科(鈴木穣教授)らとの共同研究グループの成果です。
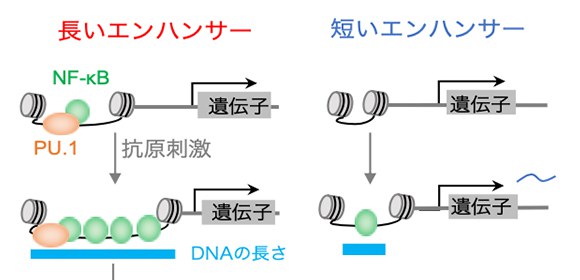
免疫応答では、サイトカインのような遺伝子の発現の量とタイミングを制御する分子機構が、免疫系を支える土台として重要な役割を担っています。特に、外からの異物に対する初期応答は、その後の免疫応答の経過を左右することから、極めて重要なステップと考えられます。しかし、免疫細胞がある特定の遺伝子だけを選び、適切な発現量をタイミングよくコントロールする仕組みはこれまでわかっていませんでした。大阪大学を中心とした本研究グループは、このことを明らかにするために、抗原に対するB細胞の初期応答を実験的に再現できるIgM抗体を用い、これをマウス由来の初代B細胞に1時間暴露し、細胞から取得した遺伝子発現とゲノムの修飾(エピゲノム)のオミクスデータをコンピュータを用いて詳細に調べました。その結果、刺激した細胞ではそうでない細胞よりも、エンハンサーと呼ばれるDNA上の遺伝子発現調節領域に、NF-kBと呼ばれる転写因子が多く結合し、また、このエンハンサーのDNA⻑と相関して、多数のNF-kBが結合し、刺激に対する応答が標的遺伝子ごとにコントロールされることを見いだしました (図1) 、 (図2左) 。そこで、特定の遺伝子でNF-kBが数多く結合する理由をDNA配列から調べたところ、NF-kBが数多く結合するエンハンサーには、PU.1という免疫細胞独特の因子と少数のNF-kBが"種"として共在し、IgM抗体刺激後、DNA上へのNF-kB結合が加速するように、事前にプログラムされていることがわかりました。また、NF-kBが複数結合できるような⻑いエンハンサーを持つ遺伝子は、IgM抗体量の増加に対して、発現量が急激に増大する閾値 様の変化を引き起こすことが、数理モデルを合わせた解析により明らかになりました。実際に、B細胞の増殖・分化に重要な役割を担うIrf4遺伝子のエンハンサー領域には、NF-kBが12箇所に結合し、このことにより、Irf4遺伝子はわずかなIgM抗体量の変化に対して急激な発現量の増大を引き起こしました。
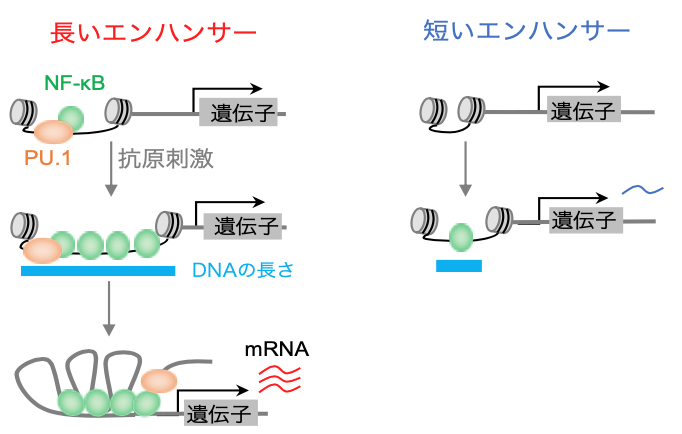
図1 抗原依存的な早期遺伝子発現制御。エンハンサーの⻑さが抗原刺激時の遺伝子発現量を決定する。PU.1因子は事前にDNAに統合し、抗原に応答してNF-kBのエンハンサーへの結合を加速する。
また、NF-kBは通常は細胞核内にはあまり存在せず、IgM抗体刺激後にB細胞受容体シグナル伝達系の活性化を通して細胞質内から核内に移行することが知られています。このことから、NF-kBの核内量をコントロールするシグナル伝達系もまた抗原応答に重要な役目を果たします。しかし、細胞集団においては、細胞の反応が少しずつ異なるため、一様にNF-kBの核内量が均一になるわけでありません。そこで、IgM抗体刺激後B細胞の核内のNF-kB量が正規分布を示すと仮定し、数理モデルを用いてシミュレーション予測を行ったところ、⻑いエンハンサーによって制御される遺伝子は、それより短いエンハンサーによって制御される遺伝子よりも、細胞間の発現のばらつきの程度が大きくなることが示されました (図2右) 。また、このことは、実データからも検証することができました。このことから、閾値機構を生み出すエンハンサーの分子機構は同時にB細胞の遺伝子発現の多様性を増やし、その後に起こりうるさまざまな細胞環境に対応できることが推測されました。NF-kBは免疫系の維持だけでなく、その過剰活性化は予後の悪いリンパ腫やがんの原因にも関わることが知られています。本成果で用いたオミクスデータ解析や数理モデルの手法は、さまざまな疾患の分子機序の解明、マーカー遺伝子の同定、創薬に応用できると考えます。
本研究成果は、国際科学誌『Cell Reports』に、6月3日(水)に公開されました。

図2 エンハンサーの⻑短による遺伝子の誘導特性。NF-kBのエンハンサーへの結合数は遺伝子発現の閾値性と発現倍加に関与する(左)。⻑いエンハンサーは細胞間の遺伝子発現のばらつきを生み出し、B細胞をさまざまな環境下に対応させる(右)。
研究の背景および内容
獲得免疫に重要な役割を担うB細胞は、抗原、サイトカイン、細胞間相互作用などにより活性化され、多数の遺伝子の発現を誘導します。このような遺伝子の一部は、免疫B細胞をさらに活性化させるために、増殖のための細胞構成材料として機能したり、抗体産生細胞として成熟させるための因子として働いたり、逆に、特殊な回路を活性化させ細胞死を誘導させることが知られています。このような遺伝子発現の機構は、その時の細胞にとって必要な遺伝子だけを、適量だけ、タイミングよく誘導させることで、B細胞の数や活性化状態を制御し、私たちのからだの免疫応答全体の調和を図ります。ある遺伝子の量が十分でなかったり、あるいは、重要な局面で遺伝子の発現が起こらないなどのタイミングがずれると、私たちを守ってくれるはずの免疫機構が機能しなくなったり、あるいは、逆に暴走することで、私たち自身の健康を脅かすことに繋がります。免疫応答では、遺伝子発現の量とタイミングを制御する仕組みが、免疫系を支える土台として重要な役割を担っています。特に、初期の抗原応答は、その後の免疫応答の経過を左右することから、極めて重要なステップと考えられます。しかし、B細胞がある特定の遺伝子だけを選び、適切な発現量をタイミングよくコントロールする仕組みはこれまでわかっていませんでした。同研究室は、以前に、B細胞受容体シグナル伝達系におけるシグナル増幅機構が、NF-kBの核内移行を閾値様に制御することを示しました(Shinohara et. al. Science 2014)。一般的に、このような閾値を生み出すような分子機構は、細胞間のばらつきを増やす機構としても機能することが知られています。本研究では、NF-kBの活性化が細胞質内および核内で複雑に制御され、そのために多様な細胞状態を生み出せることを裏付けました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、抗原による免疫応答がNF−kB転写因子とDNA側の相互作用により速やかに制御されること、また、NF-kBを制御するシグナル伝達系が免疫応答のばらつきを生み出す可能性が示されました。シグナル伝達系とNF-kB-DNA相互作用の2つの作用点への介入により、免疫応答のバランスを一細胞レベルで制御できることが考えられます。また、疾患データへの数理モデルの適用により、疾患発症機序の解明、疾患マーカーの同定、創薬等に役立てることが期待できます。
特記事項
本研究成果は、2020年6月3日(水)に国際科学誌『Cell Reports』(オンライン)に掲載されました。
論文タイトル:"The number of transcription factors at an enhancer determine switch-like gene expression"
著者:Hiroki Michida, Hiroaki Imoto, Hisaaki Shinohara, Noriko Yumoto, Masahide Seki, Mana Umeda, Tetsutaro Hayashi, Itoshi Nikaido, Takeya Kasukawa, Yutaka Suzuki, Mariko Okada-Hatakeyama
掲載雑誌:Cell Reports(セル・リポーツ)
なお、本研究は、日本学術振興会科学研究費助成事業 新学術領域研究(研究領域提案型)「代謝統合オミクス」、同科学研究費補助金 基盤研究(A)「疾病機序理解のための遺伝子ネットワーク数理モデル基盤の構築」、科学技術振興機構 未来社会想創造事業「創薬を加速する細胞モデリング基盤の構築」等の支援を得て行われました。
参考URL
蛋白質研究所 岡田研究室HP
http://www.protein.osaka-u.ac.jp/cell_systems/index_ja.html
用語説明
- B細胞
私たちのからだは細菌やウイルスの感染に対してそれを排除する免疫応答のシステムを有しています。免疫細胞の一種であるB細胞は、膜の表面にB細胞受容体(BCR)を有し、外界からの抗原がこの受容体に結合すると、細胞の増殖と分化を段階的に進め、抗原に対する抗体を産生する細胞として成熟するようになります。本研究では、B細胞の抗原応答と同様の細胞応答を実験室で誘導することのできる同族抗原のIgM抗体を使い、マウス由来B細胞のBCRを活性化させ、解析に用いました。
- 閾値
(いきち)/ここでは、閾値は、遺伝子が発現する、発現しない、の2つの極端な状態を分けることを指します。自然界においては、原因となる要素(入力)がだんだんと増えるに従い、結果となる出力もまただんだんと増えるといった現象と、要素が増えていっても最初は不感応ですが、ある量を超えたときに急激に最大値の出力を示すといった現象があります。閾値を示す現象は後者にあたります。このような閾値様の活性を示す遺伝子や分子は、がんや免疫に関わるような細胞の回路にも頻繁に登場します。
- NF-kB転写因子
(NF-kappa B)/正式には、「Nuclear factor kappa-light-chain-enhancer of activated B cells」という表記であり、炎症、感染などの免疫応答をつかさどる蛋白質として、ノーベル賞研究者デビッド・バルチモアらにより1986年に発見されました。NF-kBはもともと免疫細胞のB細胞中に発見されましたが、現在は、さまざまな細胞や組織に存在することが知られています。自然免疫や獲得免疫などの免疫応答の制御だけでなく、その過剰な活性化はがんを引き起こすことが知られています。NF-kB分子の物理化学的な性質として、蛋白質として立体構造を取りにくく、その分、DNAをはじめとしたさまざまな他の分子と相互作用しやすいといった特性があります。この特性は、核内の局所的な転写反応を増加されるのに有利だと考えられており、B細胞における抗原依存的な遺伝子発現の閾値特性の一端はNF-kB分子の性質そのものにも起因します。
- エンハンサー
エンハンサ−は遺伝子の発現調節領域に存在し、転写因子などの遺伝子発現を調節する蛋白質と結合することのできるDNA配列を指します。遺伝子の発現開始点から離れていることが特徴で、実際の遺伝子発現の際には、DNAがループを作り、開始点近傍に近づいてくると考えられています。本研究では、IgM抗体暴露により、ヒストン修飾を介して活性化したエンハンサー領域を同定しました。その結果、エンハンサーの中にも極端にDNAが⻑いエンハンサーと短いエンハンサーがあることがわかりました。⻑いエンハンサーは、⻑い分だけ多くの転写因子と結合することができ、それらが協同的に働くことにより、転写活性を強く誘導することがオミクスデータ解析と数理モデルを用いて明らかになりました。
- オミクスデータ解析
オミクス解析は、数千から数十万の生体内分子を一度に網羅的に測定し、解析する手法を指します。2003年に解読されたヒトゲノムの情報を基礎として、全遺伝子の発現プロファイリング(トランスクリプトーム)、遺伝子をコードするDNAなどの修飾(エピゲノム)、代謝物(メタボローム)、蛋白質(プロテオーム)などを測定する技術がこの10数年間で急速に進展しました。しかし、ただ、オミクスデータを数多く取得すれば、新しいことがわかるということではなく、大量のデータを解析するコンピュータ手法の開発も必須です。本研究では、細胞集団レベルでの網羅的遺伝子発現およびエピゲノムと単一細胞レベルでのエピゲノムおよび遺伝子発現といった単一細胞データのさまざまなコンピュータ解析を行うことにより、細胞ごとの抗原感受性の違いも含めて、免疫応答を詳しく調べることができました。
- 数理モデル
生物学や医学でも見られる自然界の現象の多くは数理モデルを用いて説明することができます。特に、微分方程式を用いた数理モデルの原型は、酵素の特性や蛋白質相互作用を理解するために、古典的に生物学分野で広く用いられてきました。数理モデルは、適切な実験手段が無い場合などに、取得可能な計測データから、その背後にあるメカニズムを明らかにし、さまざまな予測を可能にすることができます。本研究では、実験的には計測不可能な細胞核内の転写因子間の相互作用を、オミクスデータをもとに数理モデルを用いて予測し、遺伝子発現のメカニズムを明らかにしました。数理モデルは拡張性があるため、数理モデルの手法は、さまざまな組織の細胞の性質や疾患の悪性化などの機序解明にも役立てられています。2020年6月現在、新型コロナウイルスによる感染者の予測にも数理モデルが用いられました。基本的な考え方は、分子、細胞、個体を対象とした場合でも同様で、この汎用性および拡張性が数理モデルの良さです。微分方程式モデルは、時間変化などの定量的なパターンから、そのメカニズムを同定したり、これから将来起こりうることの予測に能力を発揮します。
