新たな遺伝子ネットワーク解析によりアルツハイマー病関連遺伝子を発見
研究成果のポイント
・アルツハイマー病の進行や脳部位を考慮した、新たな遺伝子ネットワーク解析技術を用いることで、病気の進行に伴う遺伝子間の関係の変化を脳部位ごとに推測し、新たなアルツハイマー病関連遺伝子を発見
・これまで、各脳部位で疾患ステージの進行とともにどのように遺伝子間の関係が変化するかについての解析は、技術的な課題から十分に進められてこなかった
・新規のアルツハイマー病関連遺伝子探索に有用であり、新規バイオマーカー開発や創薬における標的遺伝子探索等に役立つと期待
概要
大阪大学大学院医学系研究科の菊地正隆特任講師(常勤)、中谷明弘特任教授(常勤)(ゲノム情報学共同研究講座)らの研究グループは、国立長寿医療研究センター関谷倫子室長、飯島浩一部長と新潟大学脳研究所原範和特任助教、池内健教授とともに、アルツハイマー病患者の死後脳から異なる3つの脳部位(嗅内皮質、前頭皮質、側頭皮質)を取得し、網羅的な遺伝子発現解析を行いました (図1) 。各遺伝子の発現量データと公共のタンパク質間相互作用ネットワークデータ を組み合わせて解析を行った結果、全ての脳部位においてアルツハイマー病の進行とともに遺伝子ネットワークが崩壊していくことを明らかにしました。これまでの遺伝子発現解析では健常者グループと疾患グループの2群比較が主流でしたが、各脳部位で疾患ステージの進行とともにどのように遺伝子間の関係が変化するのかという解析は詳細な病理学データや複雑なデータ解析技術が必要となるため、十分に研究が進められていませんでした。
今回、研究グループは、遺伝子の発現データとタンパク質間の物理的な相互作用のデータを組み合わせた新しい解析手法を提案しました。この手法を複数のアルツハイマー病患者の死後脳で測定した遺伝子発現データに応用することで、アルツハイマー病の進行に伴う遺伝子ネットワークの変化を推測し、その変化に影響を与える遺伝子を同定しました。本研究成果により、アルツハイマー病の発症機序の解明に貢献することが期待されます。さらに研究の進展により、新規のアルツハイマー病関連遺伝子探索に有用であり、新規バイオマーカー開発や創薬における標的遺伝子探索等に役立つと期待されます。
本研究成果は、英国科学誌「Human Molecular Genetics」に2020年1月16日(木)に公開されました。
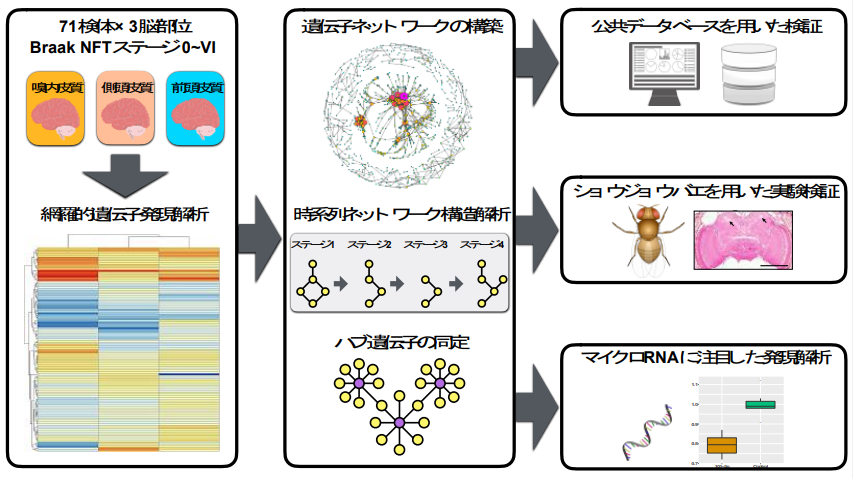
図1 遺伝子ネットワーク解析技術によるアルツハイマー病関連遺伝子の同定
研究の背景
アルツハイマー病は認知症の中で最も罹患者の割合が多く、その数は年々増加しています(World AlzheimerReport 2019)。アルツハイマー病患者の脳では神経原線維変化(NFT:neurofibrillary tangle) と呼ばれる異常なタンパク質の凝集体が観察され、神経細胞内に蓄積したNFTは神経細胞死を誘導することが知られています。NFTは記憶を司る海馬や嗅内皮質に蓄積し始め、徐々に新皮質へ蓄積が拡大していきます。それに比例して患者の認知機能も低下することが知られており、この進行ステージはBraak NFT ステージと呼ばれています(Braak and Braak (1991))。Braak NFTステージの進行に伴って、細胞内の遺伝子の発現や遺伝子間の関係も動的に変化すると考えられますが、その全容は明らかになっていません。
本研究の成果
研究グループは計71名の様々なBraak NFTステージの患者死後脳から異なる3つの脳部位(嗅内皮質、側頭皮質、前頭皮質)を取得し、エクソンアレイ法による網羅的な遺伝子発現解析を実施しました。ここで得られた遺伝子発現データを公共のタンパク質間相互作用ネットワークデータと組み合わせることで、各Braak NFTステージ、各脳部位で発現する遺伝子ネットワークを構築しました。脳部位ごとにBraak NFTステージの進行に伴う遺伝子ネットワークの構造を解析した結果、すべての脳部位で統計的有意に遺伝子ネットワークを構成するリンクが消失していき、ネットワーク全体が壊れていくことがわかりました。さらに解析を進めた結果、嗅内皮質において多くの遺伝子と相互作用するハブ遺伝子としてRAC1遺伝子を同定しました。RAC1遺伝子は特に記憶を司る嗅内皮質においてBraak NFTステージの進行とともに発現が低下し、その傾向は公共データセットでも再現されました。
RAC1遺伝子が神経変性を誘導するのかどうかを調べるために、ショウジョウバエにおいてRac1遺伝子の発現を低下させた結果、加齢依存的に神経変性が生じることが明らかになりました。このことからRAC1遺伝子は神経変性の原因となり得ることが考えられます。
RAC1遺伝子の発現低下を誘導する因子としてマイクロRNA に注目し、網羅的な発現解析を行いました。マイクロRNAは相補的な配列をもつメッセンジャーRNAと結合することでタンパクへの翻訳を阻害することが知られています。そこでRAC1遺伝子の発現と逆相関するマイクロRNAを探索した結果、hsa-miR-101-3pというマイクロRNAはRAC1遺伝子の配列と部分的に相補的な配列を有し、また嗅内皮質において最も強くRAC1遺伝子と負に相関していました。hsa-miR-101-3pが実際にRAC1遺伝子の発現を抑制するのかどうかを調べるためにヒト株化神経細胞においてhsa-miR-101-3pを過剰発現させた結果、コントロールと比べて統計的有意にRAC1遺伝子の発現が低下することがわかりました。このことから嗅内皮質ではBraakNFTステージの進行とともにhsa-miR-101-3pの発現が増加し、それによってRAC1遺伝子の発現が低下し神経変性が誘導されるという新たな発症機序の可能性を見出しました。
本研究成果が社会に与える影響(本研究成果の意義)
今回、異なる脳部位におけるBraak NFTステージの進行に伴う遺伝子ネットワークの変化を調べることにより、新たなアルツハイマー病関連遺伝子を見出しました。本研究成果により、アルツハイマー病の発症機序の解明に貢献することが期待されます。さらに研究の進展により、新規のアルツハイマー病関連遺伝子探索に有用であり、新規バイオマーカー開発や創薬における標的遺伝子探索等に役立つと期待されます。
特記事項
本研究成果は、2020年1月16日(木)に英国科学誌「Human Molecular Genetics」(オンライン)に掲載されました。
【タイトル】“Disruption of a RAC1-centred network is associated with Alzheimer’s disease pathology and causes age-dependent neurodegeneration”
【著者名】 Masataka Kikuchi 1,†,* , Michiko Sekiya 2,3,† , Norikazu Hara 4,† , Akinori Miyashita 4 , Ryozo Kuwano 4,5 , Takeshi Ikeuchi 4 , Koichi M. Iijima 2,3,* , and Akihiro Nakaya(† 共同筆頭著者、* 責任著者)
【所属】
1. 大阪大学・大学院医学系研究科・ゲノム情報学共同研究講座
2. 国立長寿医療研究センター・認知症先進医療開発センター・アルツハイマー病研究部
3. 名古屋市立大学薬学部・大学院薬学研究科・加齢病態制御学分野
4. 新潟大学脳研究所・附属生命科学リソース研究センター・バイオリソース研究部門・遺伝子機能解析学分野
5. 旭川荘・旭川荘総合研究所
なお、本研究は、日本医療研究開発機構(AMED)長寿・障害総合研究事業・認知症研究開発事業「網羅的ゲノム解析とインフォマティクス統合解析による認知症の新規病態解析」(研究開発代表者:池内健)の一環として行われ、国立長寿医療研究センター 飯島浩一 部長・関谷倫子 室長、新潟大学脳研究所 池内健 教授・宮下哲典 准教授・原範和 特任助教・桑野良三 名誉教授の協力を得て行われました。また大阪大学大学院医学系研究科 ゲノム情報学共同研究講座は同研究科 医療情報学 松村泰志 教授と日本電気株式会社(本社:東京都港区、代表取締役 執行役員社長 兼 CEO:新野隆)の協力のもと運営されています。本研究は大阪大学研究倫理審査委員会(承認番号:766)の承認を得て行われました。
参考URL
大阪大学 大学院医学系研究科 ゲノム情報学共同研究講座
http://www.comit.med.osaka-u.ac.jp/jp/project/projectA01.html
用語説明
- タンパク質間相互作用ネットワークデータ
実験で調べたタンパク質間の物理的な相互作用をネットワークとして記述したデータ。ネットワークはノード(頂点)と、ノードとノードをつなぐリンク(辺)の集合と定義される。ここではタンパク質をノード、タンパク質間の物理的な相互作用をリンクと呼ぶ。
- 神経原線維変化
異常にリン酸化されたタウタンパク質による凝集体。
- マイクロRNA
マイクロRNAは21-25塩基の長さを持つ1本鎖RNA分子。相補的な配列をもつメッセンジャーRNAと結合することでタンパクへの翻訳を阻害することが知られている。
