あらゆる組織の難治性遺伝病を治療可能に!?全身性ゲノム編集治療技術『SATI』を開発
研究成果のポイント
・新しいゲノム編集法を開発し、早老病モデルマウスの全身での治療に成功
・これまで治療対象となる遺伝子変異は限定的であったが、今回の方法で様々な遺伝子変異を様々な組織で直接修復治療することが可能に
・ゲノム編集を用いた様々な遺伝病の治療への応用に期待
概要
大阪大学高等共創研究院(大学院基礎工学研究科兼任)の鈴木啓一郎教授らの研究グループは、米国ソーク生物学研究所ベルモンテ教授らと国際共同研究グループを形成し、ゲノム編集 ツールであるCRISPR-Cas9 システムを利用し、マウス生体内の様々な組織で有効な新しい全身性遺伝子変異修復技術を開発しました。
これまで、鈴木教授らの研究グループは様々な組織で有効なゲノム改変技術「HITI(ヒティ) 」を開発し、脳や筋肉など身体中の様々な細胞内の遺伝子も自在に操ることを可能にしました。しかしながら、従来のHITI法では治療可能な対象変異が極めて限定的でした。
今回、鈴木教授らの研究グループは、HITI法をさらに改良する過程で新規の遺伝子改変機構(oaHDR) を発見し、これらの方法を組み合わせた新規のゲノム編集法「SATI(サティ) 」を開発しました。本技術を用いることで、既存の技術では治療法の存在しない優性変異 を持ち全身で異常な老化症状を示す早老症 ハッチンソン・ギルフォード・プロジェリア症候群(プロジェリア症候群)モデルマウスに対し、複数の組織や臓器で同時にゲノム編集を行い、全身性のゲノム編集治療に成功しました (図1) 。今後本技術がさらに改良されることで、成人の神経・心臓・筋肉・網膜など様々な組織または全身に異常を持つ難治性遺伝病に対し、その原因となる数多くの異常遺伝子を病変部位で直接修復する医療への応用が期待されます。
本研究成果は、国際科学雑誌「Cell Research」に掲載されるのに先立ち、オンライン版で8月23日(金)(日本時間)に公開されました。
図1 全身でのゲノム編集治療に有効なSATI法
HITI法と新規発見したoaHDR法を組み合わせた新規ゲノム編集技術。早老病のプロジェリア症候群モデルマウスで複数の臓器でゲノム編集治療への応用に成功し、寿命の延長効果がみられた。
研究の背景
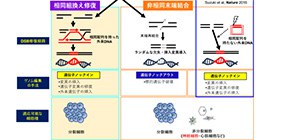
“生命の設計図”と呼ばれる遺伝子に偶発的に変異が入ると様々な疾患を引き起こす事があり、親から子へ遺伝する遺伝性疾患(遺伝病)の原因となります。一方で、そのほとんどが根治する可能性がなく有効な治療法が存在しない難治性遺伝病と言われています。近年、ゲノム配列をデザイン・改変する技術「ゲノム編集」技術が開発され、生命科学に必須の遺伝子工学技術として用いられています。ゲノム編集の原理としては、細胞が元来先天的に備えている重篤な損傷であるゲノムDNAの二本鎖切断 を修復する機構(DNA二本鎖切断修復機構)を利用します。この修復機構には、無傷な相同配列を鋳型として組換えを起こす「相同組換え修復 」 (図2左) と、相同配列に依存せず切断末端を直接結合する「非相同末端結合 」 (図2右) の、主に二つの経路が存在します。切断されたDNA末端を直接つなぎ合わせる際に、数塩基の欠失や挿入などのエラーが起こりやすい非相同末端結合経路による修復を利用することで、標的遺伝子の破壊「遺伝子ノックアウト 」ができます (図2中) 。一方、相同性を持つ外来DNA(ドナーDNA)を人為的に導入しておくと、相同組換え修復経路により誤ってゲノムに取り込まれますが、これを利用して標的配列を自由自在に改変する「遺伝子ノックイン 」が可能となります (図2左) 。これらの遺伝子改変を効率よく行うために、ゲノムの標的配列のみを特異的に切断し、DNA二本鎖切断修復を人為的に引き起こすタンパク質「CRISPR-Cas9」などが開発され、ゲノム編集技術に利用されてきました。CRISPR-Cas9は特別な技術や設備がなくても作製可能なため、瞬く間に世界中のさまざまな分野の研究者がこの技術を活用するようになり、生命科学全般に大きな影響を及ぼしました。
特に標的配列を自由自在に書き換える事ができる遺伝子ノックインは、遺伝病の治療を含め様々な用途への応用が考えられます。従来では、細胞が活発に分裂する最中に起こる相同組換え修復(DNA二本鎖切断修復機構の一種)の仕組みを利用して、ゲノム上の任意の場所に目的の遺伝子を挿入する遺伝子ノックインが行われてきました。そのため、皮膚の表皮細胞や腸の上皮細胞などを除くほとんどの生体内の細胞、特に神経細胞や心筋細胞などの細胞分裂をしていない非分裂細胞 には、この技術を適用することはできませんでした。
こういった背景の中、以前、鈴木教授らの国際共同研究グループは、非分裂細胞内でも活性を持つ別のDNA修復機構「非相同末端結合」を利用したゲノム改変技術を開発し、「HITI(ヒティ)」と名付けました (図2右) 。HITI法を用いることにより、これまで不可能であった非分裂細胞における遺伝子ノックインに成功し、生きたままのマウス・ラットの脳や筋肉など体内の様々な組織・臓器において遺伝子改変を行うことが可能になりました。また、網膜の視細胞が変性していく進行性の難病である「網膜色素変性症 」のラットモデルを利用し、疾患原因遺伝子の発現および視覚障害の部分的な回復がみられ、更に従来の相同組換え修復による遺伝子ノックイン技術を用いた場合より有意に効果が高いことを確認しました。このことから、HITIは難治性遺伝病に対する新しい遺伝子治療法に応用できる可能性があるといえました。しかしながら、HITIでは外来遺伝子を標的配列に挿入することは出来ても、ゲノム中に元々存在する変異を取り除く事が出来ないため、治療応用可能な変異が非常に限定的である事が大きな課題でした (図3左) 。
図2 DNA二本鎖切断修復機構とゲノム編集技術
本研究成果の内容
今回、鈴木教授らの研究グループでは、従来のHITI法を改良することにより、様々なタイプの遺伝子変異を様々な臓器で修復できるSATI法を開発しました。具体的には、ゲノムに存在する変異の直前に正常遺伝子の一部を非相同末端結合で組み込む事で、様々なタイプの変異を治せるゲノム編集技術となるのではないかと仮説を立て研究を進めました (図3右) 。実際に様々な細胞種でHITI法と同様に非相同末端結合による遺伝子組換えが起こっていたのですが、驚くべきことに、細胞によっては相同配列を介した組み込みがみられました。この組み込みは従来の相同組換え修復とは異なる新規のノックイン機構であるためoaHDRと名付けました (図3右) 。ここで、挿入する外来DNAの構造を工夫する事で、非相同末端結合でもoaHDRでもどちらの経路を介してノックインしても遺伝子修復可能なSATI法を開発しました。
さらに、生体内での遺伝子導入に優れたアデノ随伴ウイルス(AAV)ベクターを用いて、SATIシステムを細胞内に直接導入する「AAVSATI」を作製しました。SATI法を用いた全身性遺伝疾患への有効性を確認するため、優性突然変異を有し病的に老化が促進する早老症を発症するプロジェリア症候群のモデルマウス対してAAV-SATIを静脈注射し、治療を試みました。結果として、肝臓や心臓など複数の臓器で遺伝子修復が観察され、老化の表現型の緩和、短縮した寿命を延長することに成功し、従来法では困難であった優性変異を含む様々な遺伝子変異に対して全身でのゲノム編集治療法の開発に成功しました (図4) 。
図3 生体内ゲノム編集技術HITI法とSATI法
HITI法(左):挿入したい任意の配列(欠損している遺伝子の一部)の隣にゲノム上の標的配列と同じCRISPR-Cas9切断配列を逆向きに挿入した外来DNAを細胞に導入する。導入された外来DNA及びゲノムDNA部位の標的部位が、CRISPR-Cas9によって細胞内で同時に切断されることで、ゲノム標的部位と外来DNAが共にDNA損傷として認識され、更に非相同末端結合機構が切断断片を結合する事で、正向きの遺伝子ノックイン(HITI)が起こる。この方法では、元々ゲノム上に存在する配列を除けない。
開発したSATI法(右):点突然変異など存在するエクソンより上流のイントロンに、変異のない遺伝子の一部を持たせた外来DNAを細胞内に導入し、CRISPR-Cas9により切断する。外来DNAの片側がゲノムの標的配列と相同配列を有し、組換えを起こす新規経路(oaHDR)を発見した。SATI法では、oaHDRか非相同末端結合のどちらで挿入されても変異が修復される。また、修復標的となる変異としてほとんどの種類が対象となる。
図4 SATI法を用いた早老症モデルマウスの全身性ゲノム編集治療
AAV-SATIを生後1日のプロジェリア症候群モデルマウスに静脈注射することで、体重の増加(a)や寿命の1.5倍程度の延長効果(b)が見られる。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、今後本技術がさらに改良されることで、早老症のみならず他の神経や筋肉や網膜など様々な組織や全身に異常を持つ難治性遺伝病に対し、その原因となる異常遺伝子を病変部位で直接修復する医療への応用が期待されます。
研究者のコメント(鈴木啓一郎教授)
まだまだ乗り越えるべき課題は山積みだが、一つ一つ課題をクリアしていく事で、将来的に様々な難治性遺伝病に苦しむ患者さんの治療法として応用していきたい。
特記事項
本研究成果は、2019年8月23日(金)(日本時間)に国際科学雑誌「Cell Research」(オンライン)に掲載されました。
タイトル:“Precise in vivo genome editing via single homology arm donor mediated intron-targeting gene integration for genetic disease correction”
著者名:Keiichiro Suzuki, Mako Yamamoto, Reyna Hernandez-Benitez, Zhe Li, Christopher Wei, Rupa Devi Soligalla, Emi Aizawa, Fumiyuki Hatanaka, Masakazu Kurita, Pradeep Reddy, Alejandro Ocampo, Tomoaki Hishida, Masahiro Sakurai, Amy N. Nemeth, Estrella Nuñez Delicado, Josep M. Campistol, Pierre Magistretti, Pedro Guillen, Concepcion Rodriguez Esteban, Jianhui Gong, Yilin Yuan, Ying Gu, Guang-Hui Liu, Carlos López-Otín, Jun Wu, Kun Zhang, and Juan Carlos Izpisua Belmonte
なお、本研究は、JSPS科学研究費助成事業基盤研究(A)及び国際共同研究加速基金(帰国発展研究)の一環として行われ、米国ソーク生物学研究所ベルモンテ教授など複数の研究機関の協力を得て行われました。
参考URL
大阪大学 高等共創研究院
http://www.chem.es.osaka-u.ac.jp/suzuki/index.html
用語説明
- ゲノム編集
ゲノム配列を改変する技術。近年では、CRISPR-Cas9などの部位特異的ヌクレアーゼを用いて改変したい標的配列に二本鎖切断を人工的に導入することで、効率よく標的遺伝子の配列を改変できる。
- CRISPR-Cas9
外来性遺伝子に対する原核生物の獲得免疫機構のひとつであるシステム。Cas9タンパク質と、ガイドRNAと呼ばれる標的配列と相同な20塩基を含むshortRNAを共発現することで、核ゲノム内の標的配列を特異的に切断できる技術。clustered regularly interspaced short palindromic repeat (CRISPR)- CRISPR-associated protein 9(Cas9)の略。
- HITI
細胞が備えている非相同末端結合機構を利用し、外来DNAを標的配列に組み込ませる遺伝子ノックイン技術。鈴木啓一郎教授らの研究グループにより以前開発された技術で、生体内、特に非分裂細胞のゲノム編集に有効な技術であること。Homology Independent Targeted Integration の略。
- oaHDR
細胞が備えている相同組換え機構の一種であると考えられ、本研究で新規発見した機構。外来DNA上に片側だけゲノム標的配列と同一の配列を持たせると、ゲノムの標的部位に組み込まれる。様々な生体内の細胞に対してゲノム編集に有効な技術であることを発見した。onearmed Homology-Directed Repair の略。
- SATI
HITI法とoaHDR法を組み合わせた、外来DNAを標的配列に組み込ませる遺伝子ノックイン技術。本研究で名付け、生体内、特に非分裂細胞のゲノム編集に有効な技術であることを発見した。intercellular linearized Single homology Arm donor mediated intron-Targeting Integrationの略。
- 優性変異
父方又は母方のいずれかの一方の突然変異遺伝子を受け継ぐことにより表現型が変化すること。
- 早老症
病的な老化症状を示し、健常人より早く老化する疾患。特にプロジェリア症候群は重篤な早症であり、平均寿命は13歳である。
- DNA二本鎖切断
二本鎖DNAの両鎖が切断される重篤なDNA損傷。主に2つの二本鎖切断修復機構により修復される。
- 相同組換え
無傷な相同配列を鋳型として組換えを起こす、エラーの少ない二本鎖DNA修復機構のこと。
- 非相同末端結合
相同配列に依存せず切断末端を直接結合する二本鎖DNA修復機構のこと。
- 遺伝子ノックアウト
既知である遺伝子配列をもとにその遺伝子を破壊すること。これにより破壊された遺伝子の機能を推論できる。相同組換えで標的遺伝子に変異を入れるか、もしくは非相同末端結合で標的部位にランダムに欠失・挿入を入れることで標的遺伝子を破壊する。
- 遺伝子ノックイン
既知である遺伝子配列を基に、その遺伝子を改変し、新たな機能を持たせること。本研究以前では、相同組換えを利用することでのみ標的遺伝子の配列を任意の配列に改変することが可能であった。
- 非分裂細胞
神経細胞や心筋細胞など分裂を止めた細胞のこと。終末分化細胞とも呼ばれる。
- 網膜色素変性症
網膜の視細胞の変性により徐々に視野が狭くなり、視力を失うこともある進行性遺伝性疾患。
