iPS細胞におけるゲノム変異の解明
iPS細胞樹立時に生じるゲノム変異のホットスポットを同定
要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター機能性ゲノム解析部門の吉原正仁特別研究員(研究当時)、科学技術ハブ推進本部予防医療・診断技術開発プログラムの村川泰裕マネージャー、林崎良英プログラムディレクターと、量子科学技術研究開発機構放射線医学総合研究所放射線障害治療研究部の安倍真澄部長、大阪大学大学院医学系研究科の西田幸二教授らの共同研究グループは、マウスおよびヒトiPS細胞(人工多能性幹細胞) 樹立時に生じるゲノム変異のパターンを全ゲノムレベルで明らかにしました。
iPS細胞は、分化した体細胞に転写因子 セットを導入すること(リプログラミング)で作製される多能性幹細胞 であり、再生医療や創薬への応用が期待されています。しかし近年、iPS細胞には点突然変異(点変異) が全ゲノムの様々な領域に存在することが報告され、移植後のがん化などへの関与が懸念されています。これらの点変異の特徴やゲノム上での分布パターンについては明らかになっておらず点変異が安全性やがん化などに及ぼす影響の評価は困難でした。
今回、共同研究グループは、マウスおよびヒトiPS細胞樹立時のリプログラミングの際に生じた点変異のデータと、ヒストン修飾 などのエピゲノム データを統合し、点変異のゲノム上の分布パターンを全ゲノムレベルで調べました。その結果、マウスとヒトいずれにおいても、点変異はタンパク質をコードしている遺伝子領域およびプロモーター やエンハンサー などの遺伝子発現調節領域では低密度でした。これは、ヒトの疾患に関連する一塩基多型(SNP) が遺伝子発現調節領域に濃縮しているのとは対照的です。一方で点変異の多くは、細胞内の核膜直下に位置する核ラミナ結合領域(LAD) に高密度に存在していました。LADは遺伝子密度が比較的低く、DNAが高度に凝縮され、DNAからRNAへの転写が抑制された領域です。すなわち、iPS細胞におけるゲノム変異の多くが、遺伝子発現に影響を与えない“良性の変異”であることが示されました。さらに、リプログラミングの際に①細胞質内のミトコンドリア から活性酸素 が一過的に放出される、②放出された活性酸素によって核内の核表面に近いLADに点変異が生じる、③LADにはDNA修復酵素が届きにくいため点変異が高密度で蓄積する、というメカニズムが考えられました。
今後、iPS細胞の臨床試験例を積み重ね、ゲノムデータと臨床データを紐づけることで、これらのゲノム変異がもたらす影響について実証され、安全で有効な治療が展開されるものと期待できます。
本研究は、米国のオンライン科学雑誌『Cell Reports』に(10月10日付け:日本時間10月11日)に掲載されました。
背景
iPS細胞(人工多能性幹細胞)は、皮膚線維芽細胞などの体細胞に山中4因子(Oct4、Sox2、c-Myc、Klf4)と呼ばれる転写因子を導入すること(リプログラミング)により作製される多能性幹細胞であり、再生医療や創薬への応用が期待されています。しかし近年、iPS細胞におけるゲノム変異が報告され、移植後のがん化などへの関与が懸念されています。
iPS細胞一つから検出される点突然変異(点変異)は数百個程度といわれています。それらの点変異には、iPS細胞の親細胞にもともと存在した変異のほかにも、iPS細胞を樹立する際に新たに生じた変異も存在します。これまで、iPS細胞を用いた全ゲノムシーケンス解析 が行われていますが、点変異の特徴やゲノム上での分布パターンについては明らかではありませんでした。特に、ゲノムの約98%はタンパク質に翻訳されない非コード領域であり、これらの領域におけるゲノム変異がiPS細胞の性質に与える影響はほとんど分かっていませんでした。そのため、点変異が安全性やがん化などに及ぼす影響の評価は困難でした。
そこで、共同研究チームは、iPS細胞樹立時に発生する点変異についての解析を試みました。
研究手法と成果
共同研究チームはまず、既に全ゲノムシーケンス解析で得られていたマウスのiPS細胞樹立時に生じた2,167の点変異(iPS細胞6株分)のデータを用いて、これらの変異のゲノム上での分布を調べました。その結果、点変異はタンパク質をコードする遺伝子上には1%程度しかなく、そのほとんどが非コード領域に存在することが明らかになりました。また、各ゲノム領域における点変異の密度を解析したところ、遺伝子と遺伝子の間の領域(遺伝子間領域)で高密度であることが分かりました。
次に、点変異データをChIP-seq解析 などで得られたエピゲノムデータと統合することにより、遺伝子発現調節領域であるプロモーターとエンハンサーにおける点変異の密度を解析したところ、いずれにおいても低密度であることが分かりました。また、iPS細胞を作製する際に転写因子を導入するには、レトロウイルスベクター やエピソーマルベクター を用います。どちらのベクターを用いてiPS細胞を樹立しても、上記と同様の傾向がみられました。
また、マウスのiPS細胞樹立時に生じた点変異は、トランスバージョン型 優位の変異パターンを示すことが報告されています。この変異パターンは酸化ストレス によって引き起こされる変異の特徴であり、その一つである8-oxo-グアニン は核膜直下の核ラミナ結合領域(LAD)に多く認められることが報告されています。そこでLADに着目し、この領域における点変異の密度を解析したところ、高密度であることが分かりました。
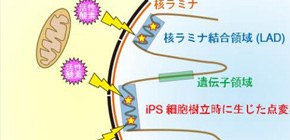
続いて、既に全ゲノムシーケンス解析で得られていたヒトのiPS細胞における5,448の点変異(iPS細胞9株分)のデータを用いて、これらの点変異のゲノム上における分布を調べたところ、マウス同様に点変異は99%以上が非コード領域に存在しており、遺伝子間領域で高密度であることが分かりました。また、エピゲノムデータとの統合解析結果もマウスと同様で、プロモーターやエンハンサーなどの遺伝子発現調節領域では低密度でした。一方、転写不活性領域であるヒストンH3リジン9トリメチル化(ヒストンH3の9番目のリジンをトリメチル化する)には高密度に存在していました。さらに、マウス同様にヒトの点変異は、LADにおいて高密度であることも分かりました (図1) 。
また、ヒトの疾患に関連する一塩基多型(SNP)のデータを用いて、SNPの分布を解析したところ、タンパク質をコードする遺伝子領域およびプロモーターやエンハンサーなどの遺伝子発現調節領域に高密度に存在することが分かりました。これは、iPS細胞における点変異とは逆の傾向を示しています (図2) 。
最後に、各エピゲノム領域においてみられたヒトiPS細胞の点変異のパターンを解析したところ、遺伝子発現調節領域ではトランジション型 の変異パターンが多くみられたのに対して、LADではトランスバージョン型の変異パターンが多くみられました (図3) 。トランスバージョン型優位の変異パターンは酸化ストレスによる変異パターンと一致しています。また、iPS細胞へのリプログラミングの初期段階で、ミトコンドリアにおける一時的な酸化的リン酸化 の上昇が報告されていることから、ミトコンドリアから酸化ストレスによる活性酸素が一過的に放出されると考えられます。
これらのことから、iPS細胞の樹立段階において、①細胞質内のミトコンドリアから活性酸素が一過的に放出される、②放出された活性酸素によって核内の核表面に近いLADに点変異が生じる、③LADにはDNAが高度に凝縮されておりDNA修復酵素が届きにくいため、点変異が高密度で蓄積する、というメカニズムが考えられました (図4) 。
図1 iPS細胞における点変異の分布
iPS細胞樹立時に生じる点変異の分布。染色体4番領域を例に示している。遺伝子密度の低い領域に核ラミナ結合領域(LAD)が存在し、この領域にホットスポット的にiPS細胞樹立時に生じた点変異が分布している。
図2 iPS細胞における点変異およびヒトの疾患に関連するSNPの分布パターン
iPS細胞樹立時に生じる点変異(左)とヒトの疾患に関連するSNPの分布(右)を示す。H3K4me1、H3K4me3、H3K27acのヒストン修飾されているゲノム領域やDNaseI高感受性領域(DHS)と呼ばれる開いたクロマチン領域にはプロモーターやエンハンサーといった遺伝子発現調節領域を含んでいるが、こうした領域にはiPS細胞樹立時に生じる点変異は低密度に存在する。一方で、H3K9me3のヒストン修飾されている転写不活性領域や核ラミナ結合領域(LAD)にはiPS細胞樹立時に生じる点変異は高密度に存在する。こうしたiPS細胞樹立時に生じる点変異の分布は、ヒトの疾患に関連するSNPの分布とは逆の傾向を示している。(*P < 0.05、** P = 1.3 × 10 −88 、*** P << 1.0 × 10 −200 )
図3 iPS細胞樹立時に生じる点変異のパターン
DNaseI高感受性部位(プロモーターやエンハンサーといった遺伝子発現調節領域を主に含む領域)には全5,448個の変異の中で、合計88個の変異をトランジション優位に認めた。対して、LADには合計3,606個もの変異をトランスバージョン優位に認めた。(Ts:トランジション、Tv:トランスバージョン)
図4 iPS細胞樹立時に生じるゲノム変異のメカニズム
iPS細胞樹立時のリプログラミングの際に、①細胞質内のミトコンドリアから活性酸素が一過的に放出される、②放出された活性酸素によって核内の核表面に近いLADに点変異が生じる、③LADにはDNA修復酵素が届きにくいため点変異が高密度で蓄積する、というメカニズムが考えられる。
今後の期待
本研究では、iPS細胞の樹立時に生じる変異の大部分がDNAからRNAへの転写が抑制された領域に生じていることを解明しました。これは、iPS細胞のゲノム変異の多くは“良性の変異”であることを示唆しており、iPS細胞の臨床応用を加速する結果であると考えられます。しかし、大多数は転写が抑制された領域に生じていても、がん化などに直接的に影響を与える部位に変異が生じることも報告されていることから、引き続き慎重に安全性を評価することが重要です。
今後、iPS細胞の臨床試験例を積み重ね、ゲノムデータと臨床データを紐づけることで、これらのゲノム変異がもたらす影響について実証されると考えられます。iPS細胞のより深い科学的な知見に基づき、安全で有効な治療が展開されることが期待できます。
論文情報
<タイトル>
Hotspots of de novo point mutations in induced pluripotent stem cells
<著者名>
Masahito Yoshihara, Ryoko Araki, Yasuji Kasama, Misato Sunayama, Masumi Abe,Kohji Nishida, Hideya Kawaji, Yoshihide Hayashizaki, Yasuhiro Murakawa
<雑誌>
Cell Reports
<DOI>
10.1016/j.celrep.2017.09.060
参考URL
大阪大学 大学院医学系研究科 脳神経感覚器外科学(眼科学)
http://www.ophthal.med.osaka-u.ac.jp/www/index.html
用語説明
- iPS細胞
iPS細胞(人工多能性幹細胞)、多能性幹細胞:
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して未分化なまま無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct4、Sox2、c-Myc、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。iPSはInduced pluripotent stemの略。
- 転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。
- 点突然変異(点変異)
ゲノム塩基配列中で一塩基のみ変異したもの。点変異ともいう。
- ヒストン修飾
ヒストンのN末端領域に認められるアセチル化、メチル化などの修飾。クロマチン構造を変化させ、遺伝子発現制御に関わっていることが報告されている。
- エピゲノム
DNAやヒストンへの化学修飾により制御される遺伝情報。
- プロモーター
プロモーター、エンハンサー:
ゲノムDNA上でRNAに書き写される領域の近くにあり、遺伝子を発現させる機能を持つ部分をプロモーターという。エンハンサーは、ゲノムDNA上で制御対象である遺伝子とは遠く離れた領域に位置し、遺伝子の転写効率を向上させる働きを持つ。
- 一塩基多型(SNP)
ヒトゲノムの個人間の違いのうち、集団での頻度が1%以上のものを遺伝子多型と呼ぶ。代表的なものとして、ヒトゲノム塩基配列上の一カ所が変化して生じる一塩基多型がある。SNPはSingle Nucleotide Polymorphismの略。
- 核ラミナ結合領域(LAD)
核ラミナとは、線維タンパク質からなるかご状の構造体で、核膜とクロマチンと相互作用し、核膜直下でのヘテロクロマチン形成や転写反応を制御する役割を担う。核ラミナ結合領域は細胞内の核膜直下に位置し、核ラミナに結合したDNA領域。LADは、遺伝子の密度は低く、DNAが高度に凝縮され転写が抑制された領域である。
- ミトコンドリア
真核細胞が持つ細胞小器官の一つであり、酸素呼吸の場である。
- 活性酸素
酸化ストレス、活性酸素:
ミトコンドリアにおける酸素呼吸によりエネルギーが産生される過程で、過酸化水素やヒドロキシラジカルを代表とする活性酸素が生じる。これらが生体内のタンパク質、脂質、核酸などと反応し、生体にダメージを与える。
- 全ゲノムシーケンス解析
次世代シーケンサーを使って、個人(約30億塩基対)やがんの全ゲノム情報を超高速に解析し、それぞれの配列の違いや変化を同定するゲノム解析技術。
- ChIP-seq解析
クロマチン免疫沈降法と次世代シーケンサーを組み合わせた網羅的解析方法。特定の転写因子やヒストン修飾に対する抗体により免疫沈降を行って、それらに結合しているDNA断片を回収し、次世代シーケンサーを用いてそのタンパク質がゲノム上のどの場所に結合しているかをゲノムワイドかつ網羅的に解析する方法。ChIPは、chromatin immunoprecipitationの略。
- レトロウイルスベクター
ベクターとは遺伝子の「運び屋」のこと。細胞に感染し遺伝子をうまく内部に運び入れてくれるウイルスを利用する場合が多い。1本鎖RNAウイルスであるレトロウイルスを用いたベクターがレトロウイルスベクターで、iPS細胞の作製にも使われている。ウイルスが持つ病原性に関する遺伝子は取り除かれている。
- エピソーマルベクター
非ウイルス性のベクターで、導入する遺伝子が導入先の細胞のゲノムに組み込まれない。エピゾーマルベクターは複製するプラスミドのため、細胞分裂に伴って導入遺伝子がある程度は複製される。iPS細胞が分裂し、培養を続ける過程で、最終的にこのプラスミドを持たないiPS細胞が大半を占めるようになる。なお、臨床で使用するiPS細胞ではプラスミドの残存がないことを確認している。
- トランスバージョン型
トランスバージョン型、トランジション型:
点変異における塩基置換は二つのタイプに分かれる。トランスバージョン型は、プリン塩基(A:アデニン、G:グアニン)がピリミジン塩基(T:チミン、C:シトシン)へ、あるいはピリミジン塩基がプリン塩基へ変異した型。トランジション型は、プリン塩基(A:アデニン、G:グアニン)が別のプリン塩基へ、あるいはピリミジン塩基(T:チミン、C:シトシン)が別のピリミジン塩基へ変異した型。
- 8-oxo-グアニン
酸化ストレスによって引き起こされる代表的な酸化的DNA損傷。グアニンが酸化されると8-oxo-グアニン(8-ヒドロキシグアニン)に変化し、ゲノムの変異を引き起こす原因にもなる。
- 酸化的リン酸化
ミトコンドリア内膜で行われ、電子伝達系を利用した、酸素の還元によるエネルギーを利用したATP(アデノシン三リン酸)生産過程。
