アミロイドβ産生酵素γセクレターゼの新たな働きを解明
アルツハイマー病やがんに対する新規の治療薬開発へ
研究成果のポイント
・アルツハイマー病治療薬のセマガセスタット など、γセクレターゼ 阻害剤とされてきた薬剤は「擬似阻害薬」であり、逆に神経細胞の中に毒性の高いアミロイドβを集積させてしまうことを発見。
・これまでに、γセクレターゼ阻害剤とされる薬剤が、アルツハイマー病や各種がんに対して約50の臨床治験で使用されてきたが、すべて失敗に終わっている。
・γセクレターゼには、アミロイドβを細胞膜の外側に放り出す働きがあることが分かったことから、今後、アルツハイマー病やがんに対する新たな治療薬の開発に期待。
概要
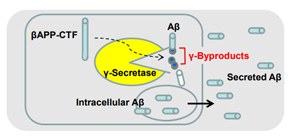
大阪大学大学院医学系研究科の大河内正康講師(精神医学)らの研究グループは、アルツハイマー病の大規模臨床治験で用いられてきたセマガセスタットなどの薬剤が、実は神経細胞内で期待された効果を全く発揮しておらず、むしろ細胞内部に毒性の高いアミロイドβを集積させてしまうことを明らかにしました (図1) 。
アルツハイマー病では、γセクレターゼ阻害薬として、アミロイドβ量を減らすことで治療が期待された開発薬の効果が得られていませんでした。
今回、研究グループは、今までγセクレターゼがアミロイドβを産生するときに自然に起こると考えられていた“細胞膜内でできたアミロイドβを膜外の水溶性領域へ放出する過程”がセマガセスタットの作用で阻害されていることを見つけました。これによりセマガセスタットはアミロイドβの産生を止めているのではなく、γセクレターゼの作用として作られたアミロイドβを細胞膜外に放出する働きを阻害していると考えられます。今後、より正確で詳細なγセクレターゼ作用の研究により、アルツハイマー病やがんに対する新たな治療薬の開発に繋がることが期待されます。
本研究成果は、米国科学誌「Cell Reports」に、10月4日(水)午前1時(日本時間)に公開されました。
図1 γセクレターゼは、アミロイドβを産生すると共に、アミロイドβを細胞外へ放出する。γセクレターゼ疑似阻害薬を細胞に作用させると、細胞内のアミロイドβが集積する。
研究の背景
アルツハイマー病の患者さんの脳内には、大量のアミロイドβ(40アミノ酸前後のペプチド)が蓄積することが知られています。γセクレターゼ阻害剤は、もともとこのアミロイドβを産生する酵素であるγセクレターゼのタンパク質分解作用を阻害し、“アミロイドβがつくられる量を減らすことで、アルツハイマー病を治療できないか”(「アミロイドβ仮説」)と開発された薬剤です。実際、いくつかのγセクレターゼ阻害剤とされる薬剤がアルツハイマー病や各種がんに対して約50の臨床治験で使用されてきました。しかし、現在二つの進行中の臨床治験以外では、全て期待された効果が得られていません。
特に、セマガセスタットなどによるアルツハイマー病の大規模治験の第3相試験 では、認知機能をかえって悪化させてしまう結果に終わっており、アルツハイマー病の根治薬開発において、「アミロイドβ仮説」そのものを揺るがしかねない事態を招いています。その失敗の原因について様々な議論がなされていますが、決定的なものは見つかっていませんでした。
そこで、大河内講師らの研究グループは、細胞内のアミロイドβや、アミロイドβと同時に産生されるペプチドに注目し、セマガスタットのγセクレターゼに対する作用を再検証しました。
本研究の成果
大河内講師らの研究グループは同志社大学井原元教授らとともに、生きた細胞内でγセクレターゼがアミロイドβをつくる際にできる小さなペプチド、「γ-バイプロダクト」(研究グループが命名)を測定するシステムを開発しました。
ヒトiPS細胞由来の神経細胞やアミロイドβを過剰に生産するマウスの脳でγ-バイプロダクトを測定した結果、セマガセスタットなどの「非遷移状態アナログ 型」とされるγセクレターゼ阻害剤は驚くべきことにγ-バイプロダクトを増加させました。また、詳細に解析すると、阻害剤であると信じられてきたそれらの薬剤により、ヒト神経細胞において、細胞の外に分泌されるアミロイドβについては減少していましたが、細胞内のアミロイドβは集積していました。同グループは、さらに、γセクレターゼにはタンパク質分解作用に加えて、その産物であるγ-バイプロダクトやアミロイドβを細胞膜内の脂溶性環境から細胞膜表面の水溶性環境へ排出させる触媒作用のようなものがあることを示しました。この結果から、セマガセスタットなどの薬剤は、多くの科学者が信じてきた“γセクレターゼのタンパク質分解作用を阻害し、アミロイドβの産生を止めている”のではなく、実は“その産物を細胞膜の外側に放り出す働きを阻害している”と考えられます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、セマガセスタットなどのγセクレターゼ阻害剤は実は真の阻害剤ではない、つまり結果的に分子標的薬の作用が本来意図していたものと異なることを明らかにしました。今回の結果は、分子標的薬の臨床応用の難しさを図らずも提示すると同時に、より正確で詳細なγセクレターゼ作用の研究・理解により、今後、アルツハイマー病やがんの新たな治療薬開発に繋がることが期待されます。
特記事項
本研究成果は、2017年10月4日(水)午前1時(日本時間)に米国科学誌「Cell Reports」(オンライン)に掲載されました。
【タイトル】“Semagacestat is a Pseudo-Inhibitor of γ-Secretase”
【著者名】Shinji Tagami 1,+ , Kanta Yanagida 1,+ , Takashi S. Kodama 1 , Mako Takami 2 , Naoki Mizuta 1 , Hiroshi Oyama 1,3 , Kouhei Nishitomi 1,3 , Yu-wen Chiu 1 , Toru Okamoto 4 , Takeshi Ikeuchi 5 , Gaku Sakaguchi 3 , Takashi Kudo 6 , Yoshiharu Matsuura 4 , Akio Fukumori 1 , Masatoshi Takeda 1 , Yasuo Ihara 2 , and Masayasu Okochi 1,* (*責任著者、+同等貢献)
1. 大阪大学 大学院医学系研究科 精神医学
2. 同志社大学 生命医科学研究科 神経病理学
3. 塩野義製薬 創薬・疾患研究所 疼痛神経部門
4. 大阪大学 微生物病研究所 分子ウイルス分野
5. 新潟大学 脳研究所 遺伝子機能解析学分野・生命情報工学分野
6. 大阪大学キャンパスライフ健康支援センター 精神科
本研究は、脳科学研究戦略推進プログラムなどの一環として行われ、東京大学名誉教授・元同志社大学 生命機能研究科教授 井原康夫先生の協力を得て行われました。
研究者のコメント
大河内正康講師・田上真次助教
「γセクレターゼ阻害薬」は製薬の方々を始めアカデミックも共同して様々な下調べをした後に臨床応用された薬剤です。世界中の科学者がその時点で知恵を尽くしていたとしても、後にその作用が実は根本的に異なるということが示されうるのです。難治性疾患の薬の開発は、こういう意味でも難しく、より良い医療を目指して真に有効な薬剤を開発するには、継続的な科学研究が必須です。
今回の基礎的発見が、新たな創薬の契機になることを期待しています。
参考URL
大阪大学大学院医学系研究科 内科系臨床医学専攻 情報統合医学講座 精神医学分野
http://www2.med.osaka-u.ac.jp/psy/
用語説明
- セマガセスタット
イーライ・リリー社が“γセクレターゼ阻害薬”として開発を試みた薬剤。2009年から行われたアルツハイマー病に対する大規模なグローバル第3相治験(2800人以上が参加)で予想外の“認知機能悪化”などの副作用のため開発が中断された。副作用のうち一部はNotchシグナル阻害や膜表面での基質の集積など、今までの知識で説明できるが、認知機能が逆に悪化したことは説明できないとされていた。
- γセクレターゼ
プレセニリンという細胞膜を9回貫通するタンパク質を中心とする酵素複合体。脂質に富む細胞膜内で数多くの基質タンパク質(~100近くのタンパク質)を分解する。その代表的産物として、アルツハイマー病の原因物質であるアミロイドβや成人T細胞白血病を惹起するNotch(ノッチ)シグナル伝達 分子、NICDがある。両者とも生理的に産生されている分子であるが、その産生量や割合が異常であると場合、当該疾患を引き起こすと考えられている。
- 第3相試験
治験は、安全性と有効性を確かめながら段階的に進められる。 第1相(フェーズ1):少人数の健康な成人で、少しずつ「薬の候補物質」の投与量を増やしていき、安全性を確認。 第2相(フェーズ2):「薬の候補物質」により効果が得られると予想される比較的少人数の患者さんで、有効性、安全性、使い方(投与量・投与方法など)を確認。 第3相(フェーズ3):多数の患者さんで、実際の治療に近い形での効果と安全性を確認。
- 非遷移状態アナログ
酵素反応においては、酵素と基質が「遷移状態(最もエネルギーが高い状態)」を形成した後にその生成物を生じる。この過渡的にしか存在しない遷移状態とよく似た構造をもち安定な化合物を遷移状態アナログと呼ぶ。遷移状態アナログ型阻害剤は、ある酵素の中心部位に直接結合して、その酵素の働きを完全に阻害する。γセクレターゼを遷移状態アナログ型阻害剤で阻害してしまうと、アルツハイマー病の原因物質であるアミロイドβのみならず、Notchシグナル伝達を司るNICDを含め、~100近くのタンパク質の細胞膜内分解を阻害してしまう。アルツハイマー病根治薬開発においては、これを回避するために非遷移状態アナログ阻害剤が数多く開発された。非遷移状態アナログ阻害剤は一般的に酵素の中心部位以外に結合して、その働きを阻害するものである。
- Notchシグナル伝達
生体の分化に重要な働きをするシグナル伝達。Notchタンパク質は生体分化において、そのリガンド分子と結合したあと、γセクレターゼによる細胞膜内タンパク質分解を受けて、Notchシグナル伝達分子、NICDを細胞内の核に放出する。これが過剰であれば成人T細胞白血病を惹起し、過小であれば正常な細胞分化が阻害され様々な障害が生じる。アルツハイマー病の根治薬開発において非遷移状態アナログ型阻害剤が選択されたのは、Notchシグナル伝達を阻害することなく、アルツハイマー病の原因物質であるアミロイドβを選択的に阻害することを目的としたためである。
