多発性硬化症の悪化を抑える免疫細胞を同定
プラズマブラストが制御性B細胞として炎症を抑制する
リリース概要
大阪大学免疫学フロンティア研究センターの松本真典助教、馬場義裕准教授、黒崎知博教授らの研究グループは、抑制性サイトカイン であるインターロイキン-10 (IL-10) がプラズマブラスト と呼ばれるB細胞 集団から分泌され、多発性硬化症の悪化を抑制することを解明しました。
研究の背景
我々の体の中では免疫系が「自己」と「非自己」を厳密に識別して、「非自己」のみを排除する機能が備わっています。しかし、一旦この免疫系が破綻してしまうと、免疫系が誤って「自己」の正常な細胞や組織を攻撃してしまい、自己免疫疾患と呼ばれる症状を引き起こすようになります。代表的な自己免疫疾患としては、多発性硬化症や関節リウマチ、全身性エリテマトーデスなどが知られています。中でも多発性硬化症は中枢性脱随疾患の一つで、脳、脊髄、視神経などに炎症が起こり、運動麻痺や感覚障害などの神経症状の悪化を繰り返す疾患です。我が国での患者数は人口10万人あたり8〜9人程度と推定されており、特定疾患に認定されている指定難病です。多発性硬化症の発症や悪化のメカニズムは未だ明らかにされていませんが、神経繊維をさやのように覆っている髄鞘と呼ばれる組織を免疫細胞が破壊することにより引き起こされると考えられています。
近年、IL-10を産生するB細胞は「制御性B細胞」と呼ばれ、多発性硬化症のマウス実験モデルである脳脊髄炎を抑制することが報告されて注目を浴びていますが、その制御性B細胞がどのB細胞集団に分類され、どのようなメカニズムを介して脳脊髄炎を抑制しているかは不明のままでした。
本研究成果が社会に与える影響(本研究成果の意義)
本研究では、IL-10を産生するプラズマブラストはB細胞から分化誘導され、樹状細胞の機能を阻害することにより、脳脊髄炎の悪化を抑制していることが明らかとなりました(下図)。
これらの結果から、IL-10を産生するプラズマブラストの分化を人為的に制御することができれば、多発性硬化症に対する新たな治療法の開発につながるものと期待されます。
特記事項
本研究は、独立行政法人科学技術振興機構(JST)の戦略的創造研究推進事業チーム型研究(CREST)「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」研究領域(菅村和夫研究総括)における研究課題「液性免疫制御による新しい治療法の開発」(研究代表者:黒崎知博)の一環として行われました。
また本研究は大阪大学、理化学研究所、九州大学、Walter and Eliza Hall医学研究所、Melbourne大学との共同で行ったものです。
掲載論文・雑誌
Masanori Matsumoto, Akemi Baba, Takafumi Yokota, Hiroyoshi Nishikawa, Yasuyuki Ohkawa, Hisako Kayama, Axel Kallies, Stephan L. Nutt, Simon Sakaguchi, Kiyoshi Takeda, Tomohiro Kurosaki and Yoshihiro Baba. Interleukin-10-producing plasmablasts exert regulatory function in autoimmune inflammation.
Immunity
2014年12月5日(金)午前2時 オンライン掲載(米国東部時間: 12月4日正午)
詳しい解説
研究の手法と成果
研究グループは、まず多発性硬化症に類似する脳脊髄炎のマウス実験モデルを用いて、IL-10を産生するB細胞がどのB細胞集団であるかを検討しました。髄鞘構成タンパク質として知られるMOG(ミエリンオリゴデンドロサイト糖タンパク質)のペプチドをIL-10レポーターマウスへ皮下注射して脳脊髄炎を誘発させたところ、所属リンパ節で分化誘導されたCD138 + CD44 hi 細胞が主要なIL-10産生B細胞であることを見出だしました (図1) 。この所属リンパ節のCD138陽性細胞は転写因子Blimp1を低レベルに発現していたことから、プラズマブラストと呼ばれるB細胞集団であることが明らかとなりました (図2) 。また、プラズマブラストへの分化にはBlimp1の発現が必須であることから、プラズマブラストが脳脊髄炎の悪化を抑制するかを検討するために、B細胞特異的にBlimp1を欠損するマウスを作製した後に脳脊髄炎を誘発させました。その結果、B細胞特異的Blimp1欠損マウスでは、有意に脳脊髄炎の増悪化が観察されました (図3) 。以上から、所属リンパ節のプラズマブラストはIL-10を産生する制御性B細胞として、脳脊髄炎の悪化を抑制していることが示唆されました。
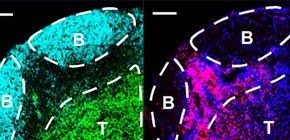
次にプラズマブラストがどのようなメカニズムを介して脳脊髄炎の悪化を抑制しているかを解明するために、まず所属リンパ節におけるプラズマブラストの局在を免疫組織染色法により検討しました。その結果、プラズマブラストはB細胞濾胞とT細胞領域の境界部位において、主に樹状細胞と共局在していました (図4) 。そこで、プラズマブラストが産生するIL-10が樹状細胞の機能を抑制するかを検討するために、野生型およびIL-10欠損プラズマブラストの培養上清下における樹状細胞のサイトカイン発現レベルを測定したところ、野生型プラズマブラストの培養上清下では、IL-10欠損プラズマブラストの培養上清とは異なり、樹状細胞の炎症性サイトカインの発現レベルが低下していました (図5) 。実際、MOG特異的なT細胞受容体を発現するナイーブT細胞と樹状細胞をプラズマブラストの培養上清下で共培養したところ、野生型プラズマブラストの培養上清下でのみエフェクターT細胞への分化が阻害されました (図6) 。これらの結果から、プラズマブラストはIL-10の産生を介して樹状細胞の機能を阻害することにより、脳脊髄炎の悪化を抑制していることが強く示唆されました。
最後に、マウスだけでなく、ヒトのB細胞においても、プラズマブラストが主要なIL-10産生B細胞であるかを検討しました。健常人の末梢血から単離したB細胞をプラズマブラストに分化誘導させたところ、プラズマブラストのみが特異的にIL-10を産生したことから、ヒトにおいてもプラズマブラストがIL-10を産生する制御性B細胞として、多発性硬化症の抑制に重要な役割を果たしている可能性が示唆されました。
今後の期待
これまで多発性硬化症を抑制する制御性B細胞の正体はほとんど明らかにされていませんでした。しかし、今回、この制御性B細胞がプラズマブラストであることが明らかにされたことにより、プラズマブラストの分化を人為的に制御することができれば、多発性硬化症に対する新たな治療法の開発につながるものと期待されます。
参考図
図1 脳脊髄炎を誘発させたマウスの各組織におけるIL-10産生B細胞
野生型およびIL-10レポーターマウスへ髄鞘構成タンパク質であるMOGのペプチドをアジュバントとともに皮下注射して脳脊髄炎を誘発させた。免疫して14日後の脾臓や所属リンパ節、脊髄から細胞を単離して各種B細胞集団のIL-10 (Venus)の発現レベルを測定したところ、所属リンパ節に局在するCD138 + CD44 hi 細胞が主にIL-10を発現した。
図2 脳脊髄炎を誘発させたマウスのCD138陽性細胞のBlimp1発現レベル
CD138陽性細胞はBlimp1と呼ばれる転写因子の発現レベルの違いにより、プラズマブラストとプラズマ細胞に分類される。Blimp1レポーターマウスに脳脊髄炎を誘発させた後に、CD138陽性細胞のBlimp1(GFP)の発現レベルを測定したところ、所属リンパ節のCD138陽性細胞はBlimp1を低レベルに発現するプラズマブラストであることが明らかとなった。
図3 B細胞特異的Blimp1欠損マウスにおける脳脊髄炎の増悪化
コントロールマウスとB細胞特異的Blimp1欠損マウス(プラズマブラストを欠損するマウス)へ脳脊髄炎を誘発させた後に、マウスの上下肢の麻痺症状を経時的に観察することにより、脳脊髄炎の麻痺症状をスコアで評価した。B細胞特異的Blimp1欠損マウスではコントロールマウスに比較して有意に脳脊髄炎の増悪化が観察された。(★ : 有意差あり)
図4 脳脊髄炎を誘発させたマウスの所属リンパ節におけるプラズマブラストの局在
脳脊髄炎を誘発させた野生型マウスから所属リンパ節の凍結切片を作製した後に、蛍光ラベルされた抗体で染色した組織切片を共焦点顕微鏡で観察した。CD138陽性のプラズマブラストは、B細胞濾胞(B220陽性)とT細胞領域(TCR陽性)の境界部位において、主にCD11c陽性の樹状細胞と共局在した。
図5 プラズマブラストによる樹状細胞のサイトカイン発現レベルの低下
野生型およびIL-10欠損マウスのB細胞からLPS(TLR4のアゴニスト)で分化誘導させたプラズマブラスト(PB)をB細胞受容体刺激し、その培養上清下におけるリンパ節由来の樹状細胞による炎症性サイトカインのmRNAの発現レベルを測定した。その結果、野生型PBの培養上清下では、樹状細胞のIL-6やIL-12aのmRNAの発現レベルが低下していたが、IL-10欠損PBの培養上清ではこれらサイトカインの発現レベルの低下は観察されなかった。(★ : 有意差あり)
図6 プラズマブラストによるエフェクターT細胞分化の阻害
MOG特異的なT細胞受容体を発現するナイーブT細胞をPBの培養上清下で樹状細胞と共培養した後に、T細胞によるIFN-γおよびIL-17産生能を測定した。野生型PBの培養上清下ではIFN-γを産生するT細胞への分化が阻害されたが、IL-10欠損PBの培養上清では、IFN-γ産生T細胞への分化はほとんど阻害されなかった(左図)。また、培養上清にTGF-γを加えてT細胞によるIL-17産生能を検討した際も同様に、野生型PBの培養上清下でのみIL-17産生T細胞への分化が抑制された(右図)。
参考URL
論文( Immunity オンラインページより)
http://www.cell.com/immunity/abstract/S1074-7613(14)00392-6
黒崎研究室HP
http://lymph.ifrec.osaka-u.ac.jp/index_j.html
用語説明
- 抑制性サイトカイン
サイトカインとは、細胞から分泌され、細胞同士の情報伝達を担うタンパク質の総称。抑制性サイトカインは免疫反応をネガティブに調整する(弱める)サイトカイン。
- インターロイキン-10 (IL-10)
代表的な抑制性サイトカインであり、免疫細胞からの炎症性サイトカインの産生を抑制する。
- プラズマブラスト
B細胞から分化誘導された細胞で形質芽細胞とも呼ばれる。
- B細胞
リンパ球の一つであり、抗体産生や各種サイトカインの産生を介して免疫反応を制御する。
