ナチュラルキラーT(NKT)細胞を活性化する自己抗原を同定
新たながん免疫療法への応用に期待
研究成果のポイント
- がん細胞を排除する性質をもつNKT細胞を活性化する自己抗原を同定。
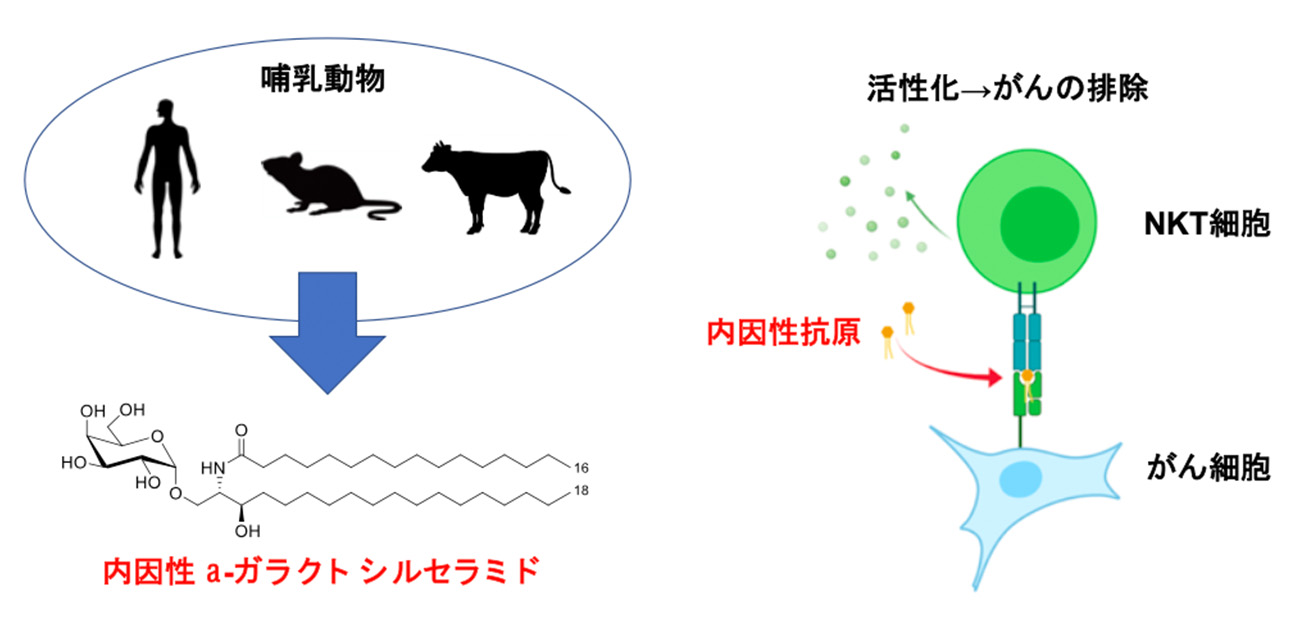
- 以前より、NKT細胞を活性化することが知られていた海洋生物由来のα-ガラクトシルセラミドが我々哺乳動物にも自己抗原として存在することを明らかに。
- ある種のがん細胞は、体内に存在しているα-ガラクトシルセラミドを取り込んで、NKT細胞に排除されていることを発見。
- がん細胞におけるα-ガラクトシルセラミドの取り込み効率を向上させることで、新たな免疫療法の開発が期待される。
概要
大阪大学大学院医学系研究科 細野裕貴特任助教(常勤)(研究当時:大阪大学微生物病研究所 博士課程大学院生)、大阪大学微生物病研究所 山崎晶教授(免疫学フロンティア研究センター、感染症総合教育拠点、ワクチン開発拠点先端モダリティ・DDS研究センター兼務)、和泉自泰准教授(九州大学生体防御医学研究所 附属高深度オミクスサイエンスセンター)らの研究グループは、ナチュラルキラーT(NKT)細胞が認識する自己抗原を同定しました。
NKT細胞は、ナチュラルキラー細胞とT細胞の性質を併せ持つ免疫細胞です。がん細胞を排除する性質があることから、がん治療を目指した臨床試験が行われています。NKT細胞を活性化させる抗原は長らく不明でしたが、海洋生物から検出されたα-ガラクトシルセラミド(α-GalCer)が強力な抗原として発見されました。しかし、我々哺乳動物の体内にはα-GalCerが存在していないと長らく考えられていたため、NKT細胞が生体内でどのような抗原を認識して分化・活性化しているか不明でした。
今回研究グループは、α-GalCerが生体内に存在しており、ある種のがん細胞はこのα-GalCerを取り込んで提示することで、NKT細胞に効率的に排除されることを明らかにしました(図1)。生体にすでに備わっている、「がんを排除する機構」を効率化させるという、新しい予防法や治療法の開発につながることが期待されます。
本研究成果は、米国科学誌「Journal of Experimental Medicine」に、12月21日(日本時間)に公開されました。
図1. NKT細胞の内因性抗原 α-ガラクトシルセラミドを同定
研究の背景
NKT細胞は自然免疫型T細胞の一つで、CD1d分子に提示された糖脂質をインバリアントT細胞受容体で認識します。NKT細胞は活性化することで迅速に多様なサイトカインを産生し、免疫系を制御します。
これまでに、海洋生物の海綿から発見されたα-GalCerや、病原体中に存在するα結合を有する糖脂質がNKT細胞の外因性抗原として知られていましたが、哺乳動物由来の内因性抗原はまだ十分に解明されてはいませんでした。哺乳動物はβ結合を有するスフィンゴ糖脂質を合成しますが、それらはNKT細胞の抗原とはならないことが知られていました。ところが近年、哺乳動物中にも自身では合成できないはずのα-GalCerがNKT細胞の内因性抗原として存在しているのではないかと考えられるようになりました。ただ、その存在量は極微量であることが推定され、精確な同定はできていませんでした。
研究の内容
研究グループは、CD1d分子を発現させた皮膚がん由来のB16F10細胞がNKT細胞を活性化させることを見出し、抗原探索をする中で血清中に存在している抗原がCD1d分子に提示されていることが明らかになりました。この細胞はマウスのがん移植実験においても、効率よく排除されることが分かりました。液体クロマトグラフィーによる分取とNKTレポーター細胞を用いたスクリーニングによって、血清中の活性成分はヘキソシルセラミドという糖脂質であることが想定されました(図2)。
図2. 血清中のヘキソシルセラミド抗原を利用し、がん細胞がiNKT細胞を活性化させた
哺乳動物自身が合成するβ-GalCer、β-グルコシルセラミド(GlcCer)は抗原にならないことから、活性成分はα結合を有するヘキソシルセラミドであると考えられましたが、これを明らかにするためには、4つの異性体(α-GalCer、β-GalCer、α-GlcCer、β-GlcCer)を分離し極微量な分子を検出できる高精度な技術が必要でした。そこで、高精度の分離能を有する超臨界流体クロマトグラフィー(Supercritical fluid chromatography, SFC)を用いて、使用するカラムのスクリーニングを行い、4つの異性体の分離に成功しました(図3)。
図3. 超臨界流体クロマトグラフィーによって、4つの異性体の分離に成功した
SFCによる分取、高分解能タンデム質量分析、鋭敏なNKTレポーター細胞アッセイを組み合わせて血清の活性成分を解析し、α-GalCer (d18:0/16:0)の精確な検出に成功しました(図4)。
図4. 血清中からα-GalCer (d18:0/16:0)を検出した
NKT細胞は肝臓に多く存在していることから、次に胆汁の活性成分を解析したところ、多くの分子種のα-GalCerが存在していることが判明しました。さらに脾臓・胸腺といったリンパ組織にもα-GalCerが存在していることが判明しました(図5)。これらの結果から、α-GalCerがNKT細胞の内因性抗原として哺乳動物中に存在していることが明らかとなりました。
図5. 胆汁、リンパ組織中からもα-GalCerを検出した
本研究成果が社会に与える影響(本研究成果の意義)
ある種のがん細胞は周囲に存在する生体由来の抗原を効率よく取り込み、NKT細胞に排除されるという新しい免疫機構を発見しました。しかし、がんの種類によってその効率は異なり、今後この違いを決める要因が明らかになれば、新しいがん免疫療法への応用が期待されます。
本研究により生体内にα-GalCerが存在することは分かりましたが、α-GalCerの合成経路は見つかっていないことから、この起源は未だ不明であり、今後の研究が期待されます。
NKT細胞は肝臓に多く存在することが知られていますが、その理由はまだ分かっていません。本研究によりα-GalCerが肝臓で作られる胆汁に多く含まれることが判明し、今後NKT細胞の局在を決定する機構の解明へ繋がることが期待されます。
特記事項
本研究成果は、2024年12月21日(日本時間)に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されました。
タイトル:“Identification of alpha-galactosylceramide as an endogenous mammalian antigen for iNKT cells”
著者名:Yuki Hosono, Noriyuki Tomiyasu, Hayato Kasai, Eri Ishikawa, Masatomo Takahashi, Akihiro Imamura, Hideharu Ishida, Federica Compostella, Hiroshi Kida, Atsushi Kumanogoh, Takeshi Bamba, Yoshihiro Izumi and Sho Yamasaki
DOI: https://doi.org/10.1084/jem.20240728
本研究は、科学研究費補助金研究 学術変革領域研究(A)(JP22H05183)、日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)(JP21gm0910010)、ワクチン開発のための世界トップレベル研究開発拠点群大阪大学シナジーキャンパス(大阪大学ワクチン開発拠点)( JP223fa627002)などの支援を受け、九州大学、岐阜大学、ミラノ大学の共同研究チームによって実施されました。
参考URL
SDGsの目標
用語説明
- NKT細胞
ナチュラルキラー細胞とT細胞の特徴を有する免疫細胞。一般的なT細胞と異なり、T細胞抗原レセプターの多様性が乏しいことから、invariant NKT細胞と呼ばれる。CD1d分子に提示された糖脂質を認識することで活性化する。多様な疾患・病態に関与していることが報告されているが、生体内での分化・維持機構についてはまだ不明な点が多い。
- 自己抗原
生体内に存在する「自分自身の成分」で、免疫システムが通常は敵とみなさず、攻撃しないタンパク質、脂質、代謝物など。一方、自己免疫疾患では、免疫システムがこれを誤って敵と認識し、攻撃してしまう。ここではNKT細胞を活性化する内因性分子。
- α-ガラクトシルセラミド
セラミドのスフィンゴイド塩基末端にガラクトースがα結合した構造をしており、海洋生物の海綿から発見された。NKT細胞の強力な抗原として知られている。担癌マウスに投与すると腫瘍縮小効果が得られることから、癌免疫療法への利用研究が進められている。
- 超臨界流体クロマトグラフィー
物質は「固体、液体、気体」のいずれかの状態として存在しているが、臨界点以上の温度・圧力状況下にすると、液体ではない気体のような「超臨界状態」となり、そのような物質を「超臨界流体」と呼ぶ。超臨界流体の中でも超臨界流体二酸化炭素は、臨界温度(31.1℃)と臨界圧力(7.38 MPa)が比較的低く、ヘキサン程度の極性を持つことから、脂質の抽出・分離プロセスに利用されている。

