
世界初! 赤痢菌の毒針(毒素分泌装置)の構造を解明
耐性菌を作らない医薬の開発に期待
国立大学法人大阪大学(平野俊夫総長)は、下記の共同研究チームが、低温電子顕微鏡法と画像解析により赤痢菌毒素分泌装置ニードルの高分解能での構造解明に成功したことを発表します。これは、大阪大学生命機能研究科の藤井高志研究員、加藤貴之助教、難波啓一教授とブリストル大学Ariel Blockerグループとの共同研究による成果で、米国科学誌「Proceedings of the National Academy of Sciences of the United States of America」の電子版で2012年2月27日 15時(米国東部時間)に公開されます。
<研究の背景>
赤痢菌など病原性細菌による感染症は発展途上国で毎年300万人以上の死者をだすなど、人類にとって未だに深刻な問題です。最近は抗生物質の効かない耐性菌も大きな問題になっており、耐性菌のできない新薬の開発が極めて重要になってきています。赤痢菌は注射針のような構造のニードル複合体と呼ばれる蛋白質分泌装置を持ち、それを用いて宿主細胞に病原性因子を注入します。ニードル複合体の立体構造を解明すれば感染の初期過程のしくみが理解でき、それを基にした新薬の開発にも大きな期待がかかっています。
<研究の内容>
本研究ではこのニードル複合体の毒針部分(図1)であるニードルについて、低温電子顕微鏡法の最新技術を用い、高分解能で立体構造を解明しました。ニードルはMxiHと呼ばれる小さなタンパク質がらせん状に積み重なった、太さわずか7 nmという極細のチューブ構造です。そのため電子顕微鏡像のコントラストは極めて低く、これまで立体構造解析はきわめて困難でしたが、電子顕微鏡の工夫や試料作成法の最適化等により、世界で初めてその微細構造の解明に成功しました(図2)。そして立体構造からは、MxiHタンパク質がどのようにしてこの極細のチューブ構造を固く安定に形成しているのかがわかりました。病原性因子はこの毒針の中央を貫通する細い穴を通して運ばれますが、その直径が約1.3 nmと非常に狭いことも明らかになりました(図3)。病原性因子がこの穴を通して運ばれる際、折りたたまって機能をもった形のままでは大きすぎて通り抜けることができません。つまり、大幅にほどかれて通過していることがわかりました。病原性因子はニードルの先端が宿主細胞に接着してはじめて菌体内から輸送され、宿主の細胞内に分泌されますが、MxiHタンパク質に変異をもつ赤痢菌の変異株の中には、このしくみが壊れて病原性因子を常に漏らしているものもいます。今回明らかになった立体構造ではそういった変異が起こるしくみも明らかになりました。逆に病原性因子をまったく分泌しないようにして、感染を防止する医薬を開発することが可能になるかも知れません。こういった薬剤は細菌自体には無毒なので、耐性菌の発生を抑制できると期待されます。
<今後の展開>
ニードルをターゲットとする新薬の開発には、さらに高い分解能の立体構造モデルが必要です。現在は、分解能を3-Åへ向上させ、より信頼性の高い原子モデルを構築することを目指して、新しい低温電子顕微鏡の開発など、さらなる技術開発に取り組んでいるところです。
さまざまな生命の仕組みを支えているのは、原子レベルで立体構造が設計された数多くの生体超分子ナノマシン間の相互作用です。生命のしくみを解明するためには、生体中の、あるいは単離しても機能を保持したままの生体超分子ナノマシンについて、立体構造を詳細に解析することが必須です。低温電子顕微鏡による生体分子の立体構造解析技術は、ごく僅かな試料でそれを可能にするもので、これからの生命科学の発展にきわめて重要な役割を果たすものと期待されています。
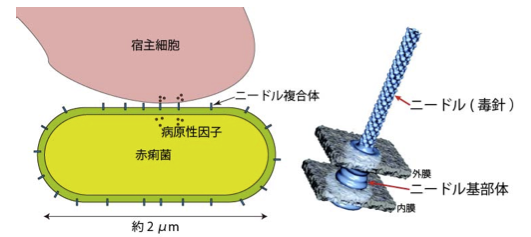
図1:感染の初期過程でニードル(毒針)を宿主細胞に接着した赤痢菌の模式図
ニードル複合体はチューブ状のニードル(毒針)と基部体からなる。基部体は菌体の膜に埋め込まれており、ニードルが宿主細胞に接着することで病原性因子の輸送が開始され、ニードルの中央を貫通する穴を通して宿主の細胞内に分泌される。

図2:ニードルとMxiHタンパク質の立体構造
(a) 構造解析に用いた長いニードルの低温電子顕微鏡像(スケールバーは20 nm)。(b) ニードルの立体構造(ステレオ像)。上半分は表面構造、下半分は内側の構造。ピンクに塗られた部分がMxiHタンパク質の一分子。ニードルはこのタンパク質がらせん状に積み重なって形成されている。スケールバーは7 nm。(c) ニードルの立体構造から一分子を切り出したもの。長いロッド状の部分はαヘリックス(H1、H2、H3)で、H2とH3の間にはMxiHの結晶構造になかったβヘアピンがあり、結晶構造が必ずしも機能を持った生体超分子の構造を示さないことを示した。(d) MxiHタンパク質の原子モデル。N端(青)からC端(赤)までをレインボーカラーで表示。(e) MxiHタンパク質のアミノ酸配列と2次構造予測。赤棒はαヘリックス、緑矢印はβ構造と予測された領域。
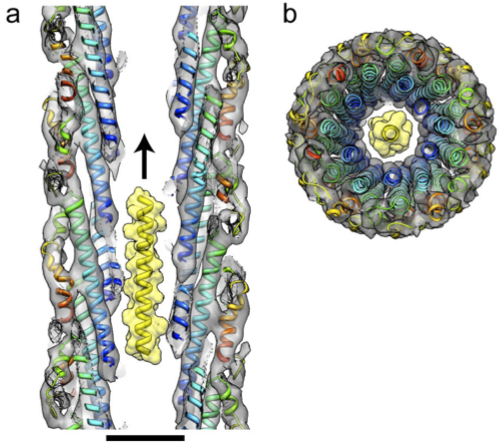
図3:ニードルの中央を貫通する極細の穴とそれを通り抜ける蛋白質分子
(a) ニードルの縦断面を横から見た図(スケールバーは2 nm)。(b) ニードルを軸に沿ってみた図。穴の直径は約1.3 nmで、αヘリックス(黄色の分子モデル)がなんとか通れる大きさ。病原性因子はこのように立体構造がほどけた状態で通り抜ける。矢印はニードルの先端に向けて病原性因子が運ばれる方向。
