未精製のアデノ随伴ウイルスベクターを直接観察・測定する新技術
遺伝子治療薬の開発に大きな一歩!
研究成果のポイント
- 遺伝子治療に使われるアデノ随伴ウイルスベクターの中身のない「空粒子」と中身のある「完全粒子」を、細胞溶解液および培養液中で、精製なしに高精度に測定する新しい方法を開発。
- 細胞溶解液および培養液中には、測定したいアデノ随伴ウイルスベクター以外に、細胞由来のタンパク質が多く含まれており、観察することが難しかったが、検出に使用する粒子を工夫することで可能に。
- 製造プロセスにおけるアデノ随伴ウイルスベクターの迅速で効率的な測定を可能にし、遺伝子治療用ウイルスベクターの製造条件の最適化を加速させるなどの波及効果が期待される。
概要
大阪大学大学院工学研究科の山口祐希助教、博士前期課程(研究当時)の下条咲希さん、内山進教授らの研究グループは、遺伝子治療に使用されるアデノ随伴ウイルスベクターの構成比(ゲノムが中に入っていない空粒子と中身のある完全粒子の比率)と、完全粒子の濃度を、ウイルスの精製を行わずにそのまま測定できる新しい技術を開発しました。
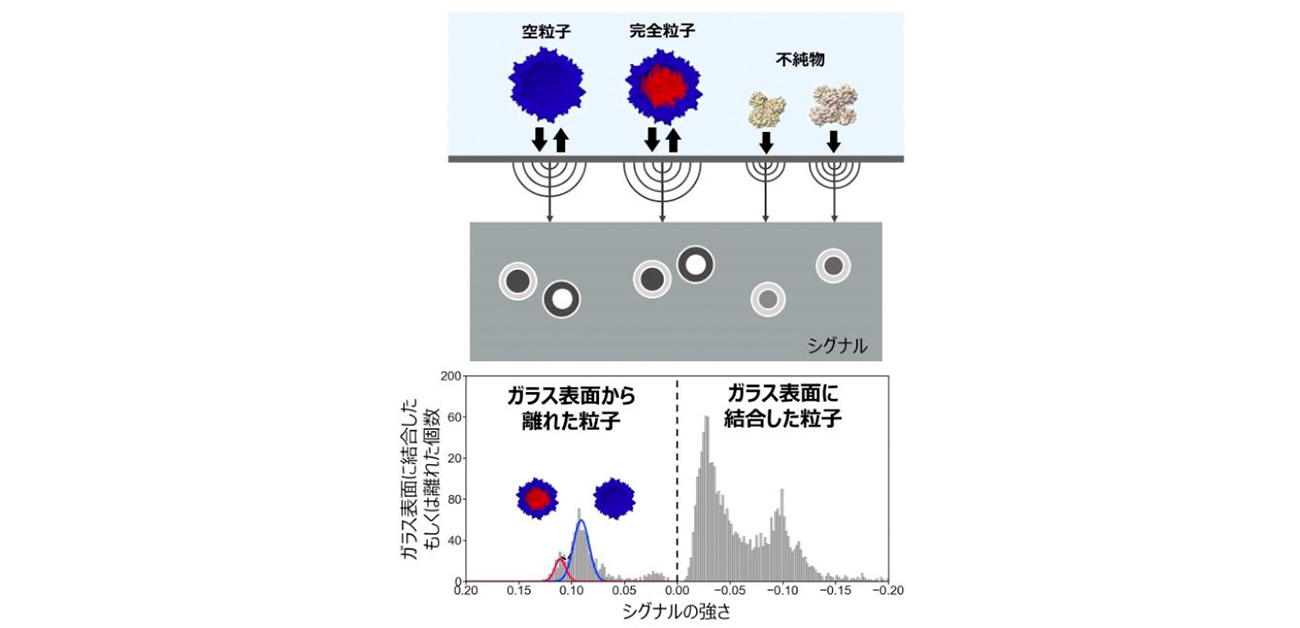
本研究では、1分子の質量を高精度で測定できるマスフォトメトリー法を応用しました。研究グループは、ウイルス粒子がガラス表面に一度結合したのち、再び離れる(unbinding)特徴的な動きをすることに着目しました。これまで、正確なウイルス粒子の定量には、超遠心分離やクロマトグラフィーなどの精製工程が必要でしたが、本手法では、細胞の溶解液や培養液中に存在するウイルス粒子を、混在する不純物と区別して直接測定することに成功しました。
この手法により、製造プロセスの初期段階にある少量のサンプルでも、ウイルス粒子の構成比やゲノム量を迅速・高精度に分析することが可能になります。遺伝子治療用ベクターの製造効率や品質管理の効率化に貢献することが期待され、将来的には他のウイルスベクターやナノ粒子の分析への応用も見込まれます。
本研究成果は、米国科学誌「Analytical Chemistry」に、5月6日(火)(日本時間)に公開されました。
図. マスフォトメトリーによるAAV粒子の観察イメージ
研究の背景
アデノ随伴ウイルス(AAV)ベクターは、遺伝子治療で幅広く利用されており、脊髄性筋萎縮症や網膜ジストロフィーなどの難病に対する治療薬に用いられています。
AAVベクターの製造プロセスにおいて、目的の遺伝子を含む「完全粒子(FP)」と、中身のない「空粒子(EP)」が同時に生成されてしまうという問題があります。空粒子は治療効果を持たないため、空粒子をできるだけ減らす必要があり、その構成比(完全粒子と空粒子の比率)や完全粒子の濃度を正確に把握することが求められていました。しかし、これまでの評価法の多くは、細胞溶解液や細胞培養液中のAAVベクターをそのまま分析することは難しく、超遠心分離やクロマトグラフィーによる精製が必要でした。
研究の内容
本研究では、1粒子ごとの質量を光で測定するマスフォトメトリーを応用し、細胞溶解液や細胞培養に含まれるAAV粒子を、精製なしで直接測定する手法を開発しました。
特に注目したのは、マスフォトメトリー法において観察される、粒子がガラス表面に一度結合し、再び離れる現象(unbinding)です。他の多くのタンパク質は、ガラス表面に一度結合したらそのまま離れません。しかし、AAV粒子はこの動きを特徴的に示すため、多数の不純物がある環境下でも、アデノ随伴ウイルスベクター粒子だけを識別する指標として利用可能であることを発見しました。
この技術により、細胞溶解液中に含まれるアデノ随伴ウイルスベクター粒子の「完全粒子」と「空粒子」の比率を、精製したときと同等の精度で直接測定できることを実証しました。また、濃度がわかっている完全粒子を複数の濃度で添加することにより、添加した濃度とマスフォトメトリーで得られた粒子数の関係から、細胞溶解液に含まれるAAV粒子の濃度も測定できることを示しました。この方法は、複数のAAV血清型(AAV2, AAV8, AAV9)において利用可能でした。また、製造初期段階の細胞培養液サンプルにおいて、培養時間を経ると完全粒子が増えていく現象を観察することに成功し、製造プロセスのモニタリングに適用可能であることを示しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、AAVベクターの製造プロセスにおける粒子構成比やゲノム量の測定が、精製ステップを必要とせず、迅速かつ高精度に行えるようになります。これにより、製造プロセスの最適化における培養条件のスクリーニングの効率化が期待できます。さらに、この手法はAAVベクターに限らず、他のウイルスベクターやナノ粒子などの評価にも応用可能であり、再生医療、ワクチン開発、創薬研究など幅広い分野への展開が見込まれます。
特記事項
本研究成果は、2025年5月6日(火)(日本時間)に米国科学誌「Analytical Chemistry」(オンライン)に掲載されました。
タイトル:“Direct Identification and Quantification of Recombinant Adeno-associated Virus in Crude Cell Lysate and Conditioned Medium by Mass Photometry”
著者名:Yuki Yamaguchi, Saki Shimojo, Risa Shibuya, Karin Bandoh, Aoba Matsushita, Mitsuko Fukuhara, Yasuo Tsunaka, Tetsuo Torisu, Susumu Uchiyama
DOI:https://pubs.acs.org/doi/10.1021/acs.analchem.5c00793
なお、本研究は、日本医療研究開発機構(AMED)の「遺伝子・細胞治療用ベクター新規大量製造技術開発・再生医療・遺伝子治療の産業化に向けた基盤技術開発事業」(助成金JP18ae0201001、JP24se0123004h0101)の助成を受け実施されました。
参考URL
SDGsの目標
用語説明
- アデノ随伴ウイルスベクター
アデノ随伴ウイルス(AAV)は、カプシド(ウイルスの外殻)によって、一本鎖のDNAが内包された構造をしている。自然界に存在するアデノ随伴ウイルスには、自己の複製に必要なRep(複製関連)遺伝子とCap(カプシド形成)遺伝子が含まれているが、遺伝子治療用のAAVベクター、すなわち「組換え型AAV(rAAV)」ではこの部分が治療用の目的遺伝子に置き換えられている。「空粒子」とはこの内包されたDNAがない、すなわち中身がない粒子を指しており、「完全粒子」とはDNAが内包されている、すなわち中身のある粒子を指す。
- 細胞溶解液および培養液
AAVベクターは、ヒト細胞や昆虫細胞を利用して製造される。AAVは血清型によって培養中に細胞から培養液中に放出されるものと、細胞内に留まり続けるものとある。本研究での細胞溶解液とは、AAVベクターを製造した細胞を界面活性剤などで溶解させたものである。また、培養液とは、培養中のフラスコからそのまま採取したもののことである。
- マスフォトメトリー法
顕微鏡のような装置で、ウイルスやタンパク質などの粒子がガラス表面に結合したとき(binding)、もしくガラス表面から離れたとき(unbinding)の、光の反射がわずかに変化する現象を観察する方法。この変化の大きさ(シグナル)が、粒子の「質量(重さ)」に比例するため、粒子1個ずつの質量を求めることができる。多くのタンパク質は、ガラス表面に結合したあとくっついたままである。したがってマスフォトメトリー法では、通常結合する粒子のみを観察する。しかし、本研究では表面から離れる粒子すなわち脱着する粒子のみを観察することで、細胞由来のタンパク質などの不純物の多い環境下でAAV由来の信号を区別することに成功した。


