アデノ随伴ウイルスベクターのゲノム放出の仕組みを解明
遺伝子治療の「運び屋」、その秘密を解き明かす!
研究成果のポイント
- 遺伝子治療で、治療用遺伝子を体内の細胞に届ける「運び屋」として機能するアデノ随伴ウイルスベクターが、加温によりゲノムを放出する際の仕組みを分子レベルで解明
- 複数の物理化学的分析手法を用いることで、カプシド(ウイルスの外殻)の一部であるVP1タンパク質のN末端領域の構造変化と、ゲノム放出が関連することを発見
- ウイルスベクターの設計や安定性の評価に新たな指針を提供し、より効率的で安全性の高い遺伝子治療用ベクター開発への応用にも期待
概要
大阪大学大学院工学研究科の山口祐希助教、下条咲希さん(当時博士前期課程)、池田智彦さん(博士後期課程)、内山進教授らの研究グループは、遺伝子治療に使用されるアデノ随伴ウイルスベクターが、VP1と呼ばれるウイルスタンパク質のN末端の領域を加温することで立体構造を変化させ、カプシド(ウイルスの外殻)の内側にあるゲノム(遺伝子)の放出を促進することを明らかにしました。
これまで、アデノ随伴ウイルスベクターがどのようにしてゲノムをカプシドから放出するのかについては議論が分かれており、その詳細なメカニズムは解明されていませんでした。
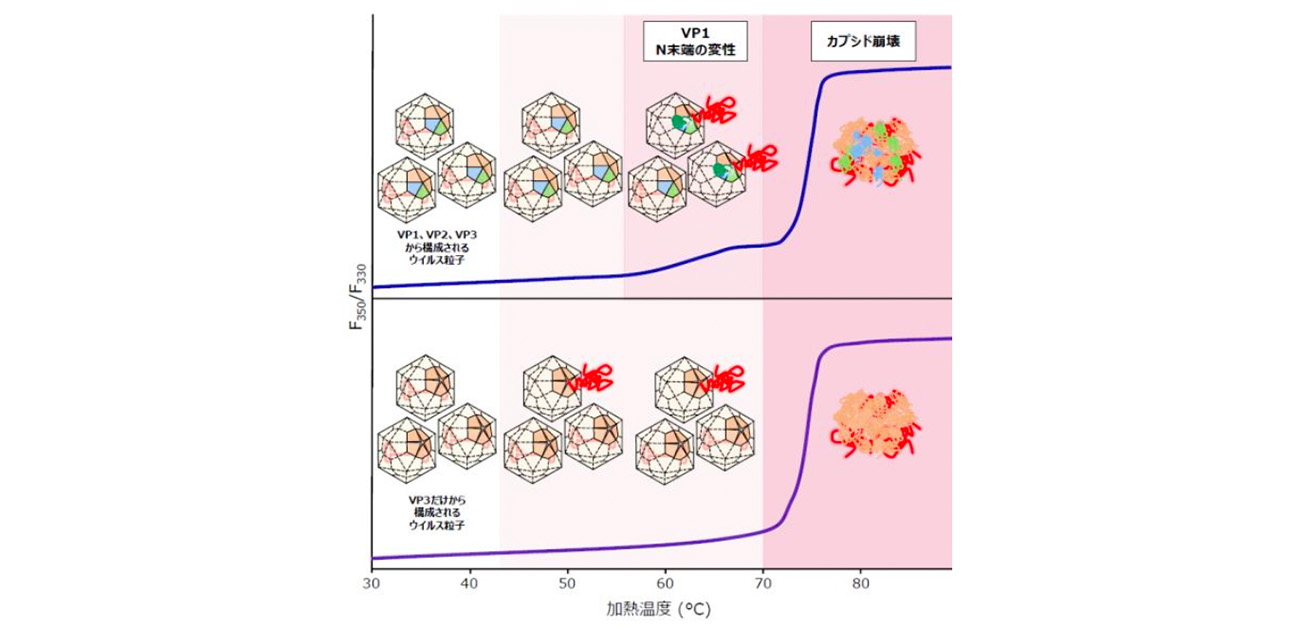
研究グループは、全てのウイルスタンパク質(VP1、VP2、およびVP3)から構成されるウイルス粒子と、VP1およびVP2を含まずVP3だけから構成される粒子を用意し、複数の物理化学的手法を駆使して、加温した際のゲノム放出を観察しました。その結果、VP1タンパク質のN末端領域(VP1だけが持つ領域とVP1とVP2が共通して持つ領域)は折りたたまれた構造を取っていて、約55~60°Cの温度で折りたたみ構造がほどけ、カプシドの中にあるゲノムが放出されやすくなることを発見しました。さらに、この構造変化はカプシドの完全な崩壊を伴わず、ゲノムを放出した後でも形を保った粒子が存在することも明らかとなりました。
これらの成果は、アデノ随伴ウイルスベクターの構造的性質と機能の関係を深く理解する上で重要であり、より効率的で安全性の高い遺伝子治療用ベクターの開発に大きく貢献すると期待されます。
本研究成果は、米国科学誌「Molecular Therapy Methods & Clinical Development」に、4月22日(火)(日本時間)に公開されました。
図1. VP1およびVP2を含むウイルス粒子と、含まない粒子のゲノム放出および構造変化の様子
研究の背景
アデノ随伴ウイルスベクターは、遺伝子治療において病気を治すための遺伝子を体内へ送る「運び屋」として、これまで治すことができなかった脊髄性筋萎縮症などの治療薬として使用されています。
アデノ随伴ウイルスベクターが遺伝子を体内に運ぶためには、カプシド(ウイルスの外殻)に包まれた遺伝子(ゲノム)を放出する必要があります。しかし、どのようにしてカプシドの中からゲノムが放出されるのかについては、研究者の間でも議論が分かれており、その詳細なメカニズムは解明されていませんでした。
研究の内容
研究グループは、アデノ随伴ウイルスベクターが細胞に取り込まれたときに、細胞に分解されるシステムから脱出する際に利用する機能ドメインを持っているウイルスタンパク質VP1に注目し、そのVP1の構造変化とゲノム放出の関係を調べました。
アデノ随伴ウイルスベクターの血清型の一種である「rAAV8」について、VP1の含有量(多い・少ない)が異なるウイルス粒子と、VP1およびVP2を含まずVP3だけから構成される粒子を用意し、温度を段階的に上げながら、カプシドの構造がどのように変化し、ゲノムがどのように出てくるのかを観察しました(図1)。観察には、マスフォトメトリー法や、示差走査蛍光定量法、水素/重水素交換質量分析、超遠心分析といった複数の分析手法を使用しました。
その結果、VP1の先端部分すなわちN末端領域が折りたたまれた状態では、ゲノムが外に出にくいこと、その部分が熱でほどけてくると、ゲノムがウイルスのカプシドから放出されやすくなることが明らかになりました。その際、カプシド表面もVP1のN末端領域の変化に伴って、構造が変化していました。また、ゲノム放出を行う際には、ウイルスの形が壊れずに、ゲノムだけが外に出ており、ウイルス粒子が、「ゲノムを放出していない粒子」、「放出したがゲノムが表面に滞在している粒子」、「放出し空になった粒子」の3つの状態をとることが明らかになりました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究は、アデノ随伴ウイルスベクターがゲノムをどのように放出するかというメカニズムを分子レベルで明らかにしたものです。
この成果により、より効率的で副作用の少ないウイルスベクターの設計が可能になり、遺伝子治療の成功率の向上や副反応の軽減が期待されます。特に、ウイルスのタンパク質がどの温度でどのように構造を変えるかという知見は、ベクターの品質管理や安定性評価にも役立ちます。
特記事項
本研究成果は、2025年4月22日(火)(日本時間)に米国科学誌「Molecular Therapy Methods & Clinical Development」(オンライン)に掲載されました。
タイトル:“Unfolding of viral protein 1 N-termini facilitates genome ejection from recombinant adeno-associated virus serotype 8”
著者名:Yuki Yamaguchi, Saki Shimojo, Tomohiko Ikeda, Mitsuko Fukuhara, Yasuo Tsunaka, Risa Shibuya, Mark Allen Vergara Rocafort, Ryoji Nakatsuka, Kiichi Hirohata, Tetsuo Torisu, and Susumu Uchiyama
DOI:https://doi.org/10.1016/j.omtm.2025.101480
なお、本研究は、日本医療研究開発機構(AMED)の「遺伝子・細胞治療用ベクター新規大量製造技術開発・再生医療・遺伝子治療の産業化に向けた基盤技術開発事業」(助成金JP21ae0201001、JP21ae0201002、JP24se0123004h0101)の助成を受け実施されました。
参考URL
SDGsの目標
用語説明
- アデノ随伴ウイルスベクター
アデノ随伴ウイルスはアミノ酸配列の長さが異なるウイルスタンパク質VP1、VP2、VP3が60個集まって構成されたカプシド(ウイルスの外殻)によって、一本鎖のDNAが内包された構造をしている。VP1はC末端側にVP2のアミノ酸配列を含んでおり、VP2はC末端側にVP3のアミノ酸配列を含んでいる。すなわち、VP1のC末端側はVP1、VP2、VP3のすべてのタンパク質で共通であり、VP1のN末端領域は、VP1だけが持つ領域とVP2と共通の領域が存在している。自然界に存在するアデノ随伴ウイルスには、自己の複製に必要なRep(複製関連)遺伝子とCap(カプシド形成)遺伝子が含まれているが、遺伝子治療用のアデノ随伴ウイルスベクター、すなわち「組換え型AAV(rAAV)」ではこの部分が治療用の目的遺伝子に置き換えられている。
- マスフォトメトリー法
顕微鏡のような装置で、ウイルスやタンパク質などの粒子がガラス表面にくっついたときの、光の反射がわずかに変化する現象を観察する方法。この変化の大きさが、粒子の「質量(重さ)」に比例するため、粒子1個ずつの質量を求めることができる。本研究では、ゲノムを放出したウイルス粒子が、放出していない粒子より質量が小さくなる現象を観察した。
- 示差走査蛍光定量法
タンパク質が加熱によってどのように変性(構造が変化)するかを、蛍光を使って測定する方法。三次元構造を形成するタンパク質は、熱を加えると折りたたまれた構造がほどけていく性質(変性)を持ち、そのような構造変化によりタンパク質を構成するトリプトファンなどの蛍光アミノ酸の光の放出挙動が変わるので、温度とともに蛍光の変化を測定することで、どの温度で構造が変化し、変性が開始、および完了するかがわかる。
- 水素/重水素交換質量分析
タンパク質を含む溶液を通常の水(H₂O)から重水(D₂O)で置き換えると、水分子と接している部分では水素(H)から重水素(D)へと置き換わりやすいという性質を利用し、質量分析でDに置き換わった部分を検出することで、水分子に接していた部分や柔らかく動きやすい構造部分を特定することができる。本研究では加温前後の構造を比較するために使用した。
- 超遠心分析
高速回転によって大きな遠心力を溶液に加えると、分子が拡散しながら沈降する。その沈降の挙動を紫外線の吸収などでリアルタイムに観察した後、得られたデータをコンピューターで解析することで分子の大きさや形を測定する方法。ウイルスやタンパク質を超遠心分析装置で高速回転させると、分子量が大きく、形状が丸いほど、分子は速く沈む。


