難病『ミトコンドリア心筋症』の進行メカニズムを発見
患者とモデルマウス研究の統合による病態解明
概要
国立循環器病研究センター(大阪府吹田市、理事長:大津欣也、略称:国循)分子薬理部 Tasneem Qaqorhリサーチフェロー、新谷泰範部長の研究グループは、国循小児循環器内科、移植医療部、病理部、先端医療技術開発部、創薬オミックス解析センターおよび、大阪大学大学院生命機能研究科 高島成二教授をはじめ、京都大学、九州大学、北海道大学、順天堂大学、埼玉医科大学、メルボルン大学との共同研究により、ミトコンドリア心筋症の病態進行過程で「転写因子Atf3が重要な運命決定因子として機能する」ことを明らかにしました。
ミトコンドリアは私たちの体のほぼ全ての細胞の中にある
ミトコンドリアは細胞が使用するほとんどの生体エネルギーを産生する工場の役目を果たします。ミトコンドリアの機能不全は、細胞の活動を低下させ、ひいては臓器の機能不全を引き起こします。ミトコンドリアで働く遺伝子の先天的な変異によりミトコンドリア機能不全が生じる病気を総称してミトコンドリア病と呼びます。ミトコンドリアは私たちの体のほぼ全ての細胞に存在するため、どの臓器にも障害が生じる可能性があります。たとえば、脳の神経細胞であれば、見たり、聞いたり、物事を理解したりすることが障害されます。心臓の細胞であれば、心機能が低下し、血液を全身に送ることがしづらくなります(ミトコンドリア心筋症)。症例によって異なる組み合わせで臓器障害を呈することがありますが、心筋障害の有無、すなわちミトコンドリア心筋症の合併は患者さんの予後を左右する大きな要因となります
(Int. J. Cardiol. 341, 48–55, 2021)。
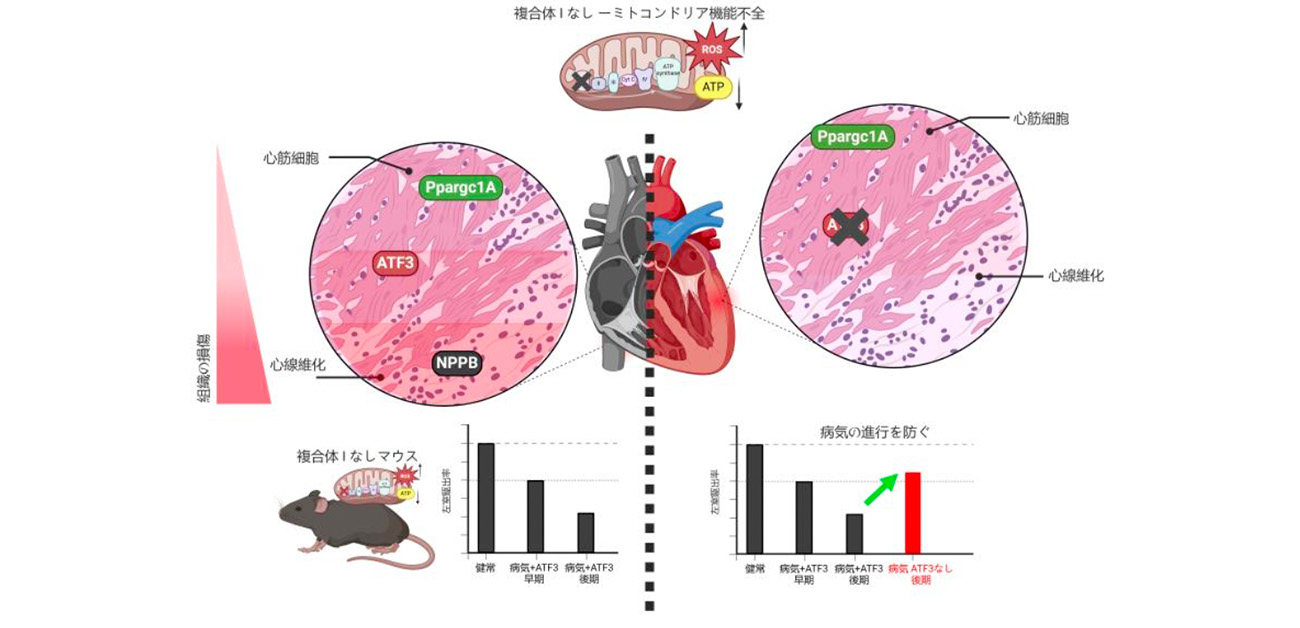
図1. (左) ミトコンドリア心筋症の病初期にはミトコンドリアの数を増やす転写因子Ppargc1aが働いている。ATF3の発現は病気の進行を進めるトリガーとなり、心不全のマーカーとなるNPPBが上昇、線維化が進んでいく。
(右) 疾患モデルマウスでATF3を消失させると、病気の進行を抑制することが可能 Created in BioRender. Qaqorh, T. (2025)
https://BioRender.com/g79u507
ミトコンドリア心筋症、ミトコンドリア病は有効な治療法がない難病
ミトコンドリア心筋症、ミトコンドリア病はミトコンドリアでのエネルギー産生機構の機能不全が根本原因で、有効な治療法がない難病です。これまで病態の進行増悪に至る過程は十分には解明されていませんでしたが、今回、国循で診療されたミトコンドリア心筋症の患者組織を用いた遺伝子発現解析とミトコンドリア心筋症モデルマウスの心臓を用いた単一細胞遺伝子発現解析を組み合わせ、ミトコンドリア心筋症の進行過程を擬似的にトレースすることに成功しました。病初期にはミトコンドリアの機能低下を補填するため、ミトコンドリアの数を増やす代償機構が機能しますが、Atf3がその代償機構をスイッチオフさせることにより病態を進行させることを明らかにしました。ミトコンドリア心筋症、ミトコンドリア病は、現在世界中の研究機関、製薬会社で病態メカニズムの解明と新規の創薬標的の探索が進んでおり、今回の成果が今後の治療薬開発につながることが期待されます。
研究手法
病態進行因子を明らかにするため、次の二つのアプローチを用いました。
① 国循で診療された8ヶ月齢女児のミトコンドリア心筋症患者組織を用いた遺伝子発現解析を実施
超重症心不全で補助循環が必要となる状態でしたが、予想外に心筋組織は不均一で、変性の少ない心筋(図2:組織像の左半分)と変性が多く病態が進行した心筋(図2:組織像の右半分)が混在していました。組織切片上で遺伝子発現解析を実施したところ、心不全で上昇する遺伝子NPPBは、組織切片の右側に強く、左側では上昇しておらず、組織切片所見に合致するものでした。これは比較的変性の少ない左側から右側への進行を想像させるものであり、左側で強く発現する遺伝子を探索したところ、ATF3を見出しました。患者組織から細胞を調整し、単一細胞レベルの遺伝子発現解析も進めたところ、ATF3の発現上昇とともにミトコンドリアの数を増やすように働くPPARGC1Aの発現が低下し、NPPBを発現する不全心筋に移行する様子を思わせる病態進行過程が導き出されました(図2右)。
②ヒトミトコンドリア心筋症患者で見出した知見を検証するため、ミトコンドリア心筋症モデルマウス(FS6KDマウス)の心臓を用いて単一細胞遺伝子発現解析を実施
モデルマウスで複数のタイミングで検討を進めたところ、心機能低下が軽度な生後4−8週齢の病初期のマウス心臓には、ミトコンドリアを増やすPpargc1aを非常に強く発現している心筋細胞が多く、代償期と考えられました。しかしその中に少数ですが、すでに不全心筋のマーカーであるNppbの発現が認められる細胞群が混じっており、不均一性が高いことがわかりました。モデルマウスの1細胞遺伝子発現解析では、細胞数も多く解像度の高い解析が可能であったため、擬似的に導き出した病態進行過程を描出し、細胞の運命決定に関わる転写因子に注目して解析したところ、病態進行の移行期に一過性に発現が上昇する遺伝子としてAtf3を同定しました(図3左)。
ヒト組織でも同様にAtf3が注目分子として上がってきたことより、ミトコンドリア心筋症モデルマウスにおいてAtf3を先天的に欠損するマウスを作成しました(図3右、Atf3-/-FS6KD)。このマウスでは、心機能の低下が抑制されており、ミトコンドリア心筋症モデルマウスでAtf3を欠損させることにより心保護効果が見られることが明らかになりました。
図2. (左) 8ヶ月齢 ミトコンドリア心筋症女児の心筋組織像。予想以上に異なるステージの心筋組織が混在していた。(右) 1細胞遺伝子発現解析から擬似的に導き出した病態進行過程
図3.
(左) モデルマウスの1細胞遺伝子発現解析から擬似的に導き出した病態進行過程。移行期にAtf3が上昇する。
(右) 疾患モデルマウスでAtf3を消失させると、病気の進行を抑制することが可能
今後の展望と課題
補助循環が必要な末期重症心不全のミトコンドリア心筋症の心筋組織は、全ての細胞が終末期のように思えますが、実際には進行度の異なる細胞が入り混じっている可能性があることが今回の研究で明らかとなりました。治療介入の余地のある心筋細胞が残存する可能性を示唆するものであり、そういった心筋細胞の存在を予測し、治療に結びつける技術の開発が望まれます。今後さらに研究を進めて、ミトコンドリア心筋症、ミトコンドリア病の新しい診断・治療法を開発したいと考えています。
特記事項
本研究成果は、国際学術誌「Science Advances」に令和 7年 4月5日付(US ET 金曜14時, 04 April 2025.)でオンライン掲載されました。
著者: Tasneem Qaqorh, Yusuke Takahashi, Kohei Sameshima, Kentaro Otani, Issei Yazawa, Yuya Nishida, Kohei Tonai, Yoshitaka Fujihara, Mizuki Honda, Shinya Oki, Yasuyuki Ohkawa, David R.Thorburn, Ann E. Frazier, Atsuhito Takeda, Yoshihiko Ikeda, Heima Sakaguchi, Takuya Watanabe, Norihide Fukushima, Yasumasa Tsukamoto, Naomasa Makita, Osamu Yamaguchi, Kei Murayama, Akira Ohtake, Yasushi Okazaki, Takanari Kimura, Hisakazu Kato, Hijiri Inoue, Ken Matsuoka, Seiji Takashima, Yasunori Shintani*
題名: Atf3 controls transitioning in female mitochondrial cardiomyopathy as identified by spatial and single-cell transcriptomics.
掲載誌: Science Advances
DOI: 10.1126/sciadv.adq1575
本研究は、下記機関より資金的支援を受け実施されました。
日本医療研究開発機構 (AMED):JP21ek0109499
文部科学省科学研究費:23K18295, 24K02453, 23H00372, 22H04676, 22K19275
国立研究開発法人国立循環器病研究センター循環器病研究開発費:21-2-7
公益財団法人宮田心臓病研究振興基金、公益財団法人先進医薬研究振興財団
高深度オミクス医学研究拠点整備事業(九州大学)
