ミトコンドリアの謎をひとつ解明!
エネルギー産生促進分子を発見
本研究成果のポイント
・エネルギー産生の調節機構をおこなうタンパク質を新たに同定しました。
・生体内で最も重要なエネルギー産生酵素の分子メカニズムの一端が明らかになりました。
・ミトコンドリア病、虚血性疾患、糖尿病、心不全、癌などの治療につながる可能性があります。
リリース概要
大阪大学大学院医学系研究科内科学講座(循環器内科学)の朝野仁裕助教、生化学・分子生物学講座(医化学)新谷泰範助教らの研究グループは、ミトコンドリアにおけるエネルギー産生の新規調節分子(Higd1a)を発見しました。あわせてHigd1aは低酸素環境で発現が誘導され、ミトコンドリアの呼吸鎖複合体IV(チトクロームcオキシダーゼ)に結合して、エネルギー産生効率を上昇させることを世界ではじめて明らかにしました。
酸素を利用したミトコンドリアにおけるエネルギー産生は高等生物の根幹的機構であり、その異常は神経変性疾患やミトコンドリア病など多様な臓器障害を呈することが知られています。しかしながら、これまでエネルギー産生の促進分子やその正の調節メカニズムは全くと言っていいほど不明でした。本研究の成果は、ミトコンドリアにおけるエネルギー産生亢進を目指した新たな治療法開発などの応用につながることが期待されます。
本研究成果は、2015年1月19日15時(米国東部時間)に米国科学誌「米国科学アカデミー紀要」のオンライン版で公開されました。
研究の背景
高等生物は高エネルギー化合物であるATPの産生に酸素を必要とし、そのATPの大部分を細胞内小器官であるミトコンドリアで産生しています。ミトコンドリアは一つの細胞に数百から数千個存在しており、特に脳や心臓といったエネルギーを多量に必要とする臓器には多く存在しています。このATPを分解して得られるエネルギーを使うことで様々な生命活動が可能となります。
ミトコンドリアにおける酸素を利用したATP産生は酸化的リン酸化とよばれ、5つのタンパク質複合体から構成される一連の酵素反応により成り立っています。そして、酸素を実際に利用するのは4番目の複合体であるチトクロームcオキシダーゼ(CcO)です。TCA回路から供給された電子は、酸化的リン酸化によって最終的にチトクロームcオキシダーゼで酸素に授与され、生体にとって無害な水に変換されます。この電子の移動は、膜を隔てて濃度勾配が形成されている水素イオンを濃度勾配に逆らって汲み出すプロトンポンプと共役しています。この水素イオン濃度勾配がATPを産生する駆動力となります。そして、生体では大部分の酸素が酸化的リン酸化によって、このチトクロームcオキシダーゼで消費されることが解っています。
一方で、生体は酸素濃度の変化を感知して様々な遺伝子の発現を調節することが知られています。そして、生体において大部分の酸素を消費するチトクロームcオキシダーゼも酸素濃度によりその酵素活性が調節されていると考えられていますが、その調節分子メカニズムは不明でした。
研究の内容
今回、朝野・新谷らのグループは酸化的リン酸化の活発な培養心筋細胞で低酸素環境において誘導される遺伝子群のなかから、ミトコンドリアに局在するHigd1aに着目しました。培養心筋細胞を用いた生化学的解析によりHigd1aはチトクロームcオキシダーゼに結合していることが判明しました。ウシ心臓由来のチトクロームcオキシダーゼの結晶構造は、かつて現兵庫県立大学の吉川信也教授や月原冨武教授のグループによって解明されています。今回、我々は彼等との共同研究によって結晶構造解析可能な高精製度のタンパク複合体であるチトクロームcオキシダーゼを用いて、生化学的な解析をさらに進めました。そして、高精製度のチトクロームcオキシダーゼが大腸菌で産生し精製したHigd1aと結合すること、さらにチトクロームcオキシダーゼ活性が結合によって約2倍に上昇することを明らかとしました。背景にある分子メカニズムを解明するために共鳴ラマン法で解析を行ったところ、Higd1aの結合でチトクロームcオキシダーゼの活性中心の構造が変化することを発見しました。これは、Higd1aが電子の流れと共役しているチトクロームcオキシダーゼ内のプロトンポンプに作用することでATP合成 (図1) に影響するという新たなメカニズムを示したことになります。
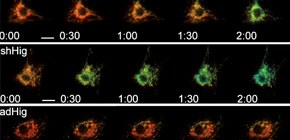
再び、培養心筋細胞を用いてHigd1aの効果を検討したところ、Higd1aのノックダウンによって心筋細胞におけるチトクロームcオキシダーゼ活性が減少し、それに伴って酸素消費量も減少するということがわかりました。一方で、Higd1aを過剰発現するとチトクロームcオキシダーゼ活性が上昇し、酸素消費量も増加するという結果を得ました。この活性の変化がATP産生に及ぼす影響を検討したところ、Higd1aのノックダウンによってATP産生は減少し、Higd1aの過剰発現によってATPの産生が増加するという、チトクロームcオキシダーゼ活性と酸素消費量に相関した結果を得ました。さらに生細胞内でATP産生を可視化するFRETを用いた実験系によって解析を行ったところ、ATP産生の変化は心筋細胞を低酸素環境で培養した際に顕著で、Higd1aのノックダウンによって低酸素環境における耐性が低下し、Higd1aの過剰発現によって低酸素環境における生存率が上昇するという結果に繋がりました (図2) 。
本研究成果が社会に与える影響(本研究成果の意義)
本研究により、ミトコンドリアにおけるATP産生の新規調節因子が明らかとなりました。いまだ十分には解明されていない電子伝達系の仕組みに迫るものであり、外的要因によってATP産生調節機構を生体が有していることを示しています。また本研究の成果は、エネルギー産生に問題のある糖尿病や癌、神経変性疾患、更には難病指定されているミトコンドリア病といった疾患の治療法開発に繋がる可能性があります。
参考図
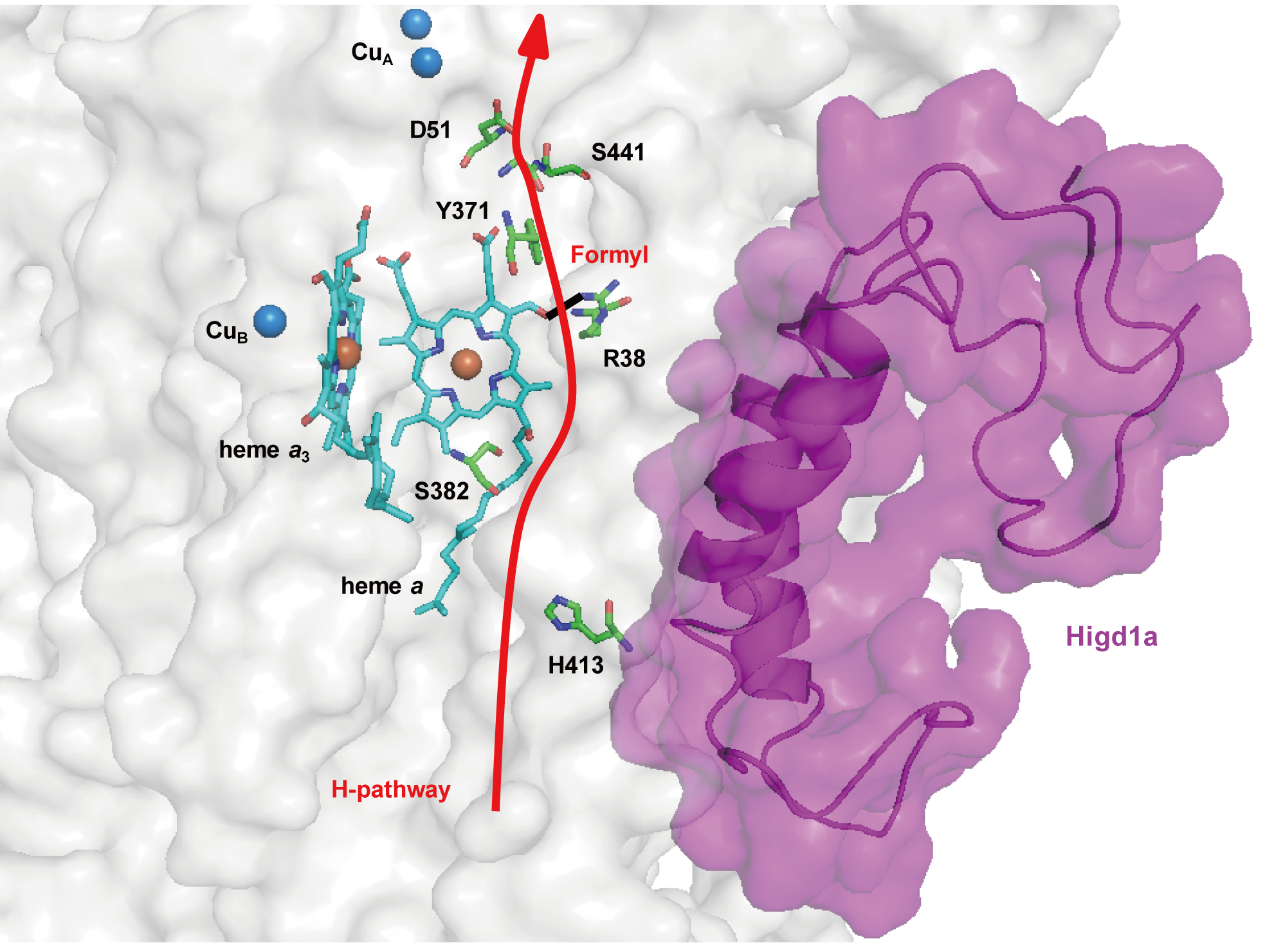
図1 Higd1aの結合により引き起こされるCcOのプロトンポンプへの影響を示した模式図

図2 FRETを用いた生細胞内でのATP濃度変化
低酸素環境で観察。上段がコントロール細胞。 中段はHigd1aのK.D. 下段はHigd1aの過剰発現。
