全身性自己免疫疾患の発症機構を解明
T細胞によるセルフとネオセルフとの識別能が原因であることを発見
研究成果のポイント
- ウイルス等を排除する免疫細胞が、自己免疫疾患ではなぜ自己の組織や細胞を攻撃してしまうかが長年の謎であった。
- 本研究は、免疫の司令塔であるT細胞が異常な自己抗原であるネオセルフを非自己(ノンセルフ)として認識して自己の組織を攻撃してしまうことが、自己免疫疾患の原因であることが明らかにした。
- 自己免疫疾患のリスクとされる持続感染ウイルスのEBウイルスの再活性化により、ネオセルフが誘導されると、自己免疫疾患を引き起こす病原性のT細胞が活性化された。この発見は、これまで不明だったウイルス感染と自己免疫疾患の関係を解明したものである。
- 本研究成果は、「免疫の司令塔であるT細胞がネオセルフを非自己(ノンセルフ)として認識する」ことを示した従来の免疫学の基本概念を大きく変える発見である。様々な自己免疫疾患の原因を標的にした新規治療法の開発や、生理的、病的な様々な免疫応答を理解する上でも極めて重要な発見である。
概要
大阪大学免疫学フロンティア研究センター/微生物病研究所・ワクチン開発拠点 先端モダリティ・DDS研究センター/感染症総合教育研究拠点の森俊輔 特任研究員(常勤)、荒瀬尚教授らの研究グループは、免疫応答の司令塔のT細胞に抗原を提示するMHC(主要組織適合性遺伝子複合体)の機能異常によって、異常な自己抗原(ネオセルフ)が提示され、その結果、ネオセルフに対する免疫応答が惹起されることが自己免疫疾患の原因であることを突き止めました。
通常、免疫細胞はウイルス等の感染細胞等を非自己(ノンセルフ)として認識して攻撃しますが、正常な自己の細胞は認識しません。自己免疫疾患では自己の細胞や組織に対する免疫応答が起きて攻撃してしまいますが、その原因は長年にわたり不明でした。
荒瀬尚教授らの研究グループは、MHCの機能異常を引き起こしてネオセルフを誘導できるマウスを樹立することで、ネオセルフが全身性の自己免疫疾患を発症させることを発見しました。さらに、全身性自己免疫疾患である全身性エリテマトーデス(SLE)の患者さんで異常に活性化しているT細胞の約10%もが、ネオセルフを認識していることを発見しました。一方、ほとんどの成人に持続感染しているEBウイルスの再活性化頻度はSLE発症のリスクとして知られています。本研究により、EBウイルスの再活性化によってMHCの機能異常が引き起こされた結果、ネオセルフが生じてSLE患者さんの自己応答性T細胞を活性化することが明らかになり、持続感染ウイルスの再活性化による自己免疫疾患の発症機構が判明しました(右上図)。
本研究成果は、米国科学誌「Cell」に、9月14日(土)0時(日本時間)に公開されました。
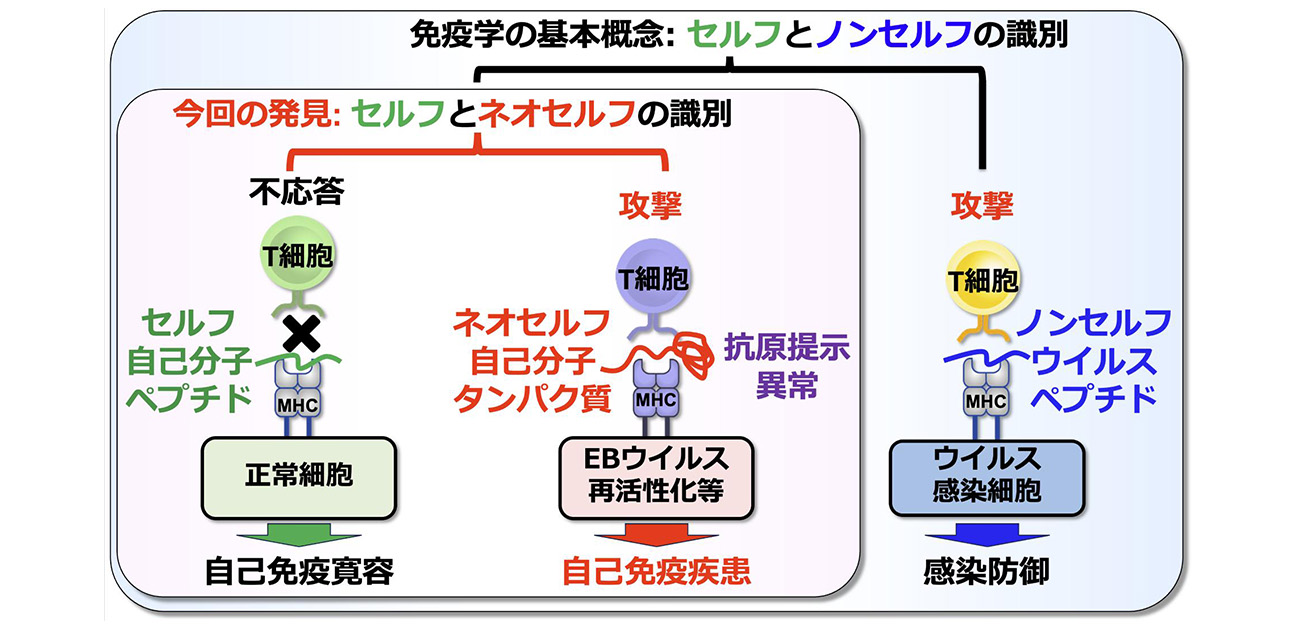
図. 本研究によりT細胞がセルフとネオセルフを識別し、その識別能が自己免疫疾患の原因になっていることが明らかになった。
研究の背景
特定のMHCの遺伝型はほとんどの自己免疫疾患のもっとも強い遺伝的リスク要因であります。T細胞はMHCに提示されたウイルス等の抗原を認識しますが、T細胞は分化成熟する際にMHCに提示された自己抗原に対して寛容(不反応)になるために、自己抗原には反応しません。これはT細胞による自己(セルフ)と非自己(ノンセルフ)の識別と呼ばれ、免疫学の基本概念になっています。しかし、この従来の基本概念だけでは、なぜ自己免疫疾患で、特定の自己抗原に対する免疫応答が引き起こされるのか、なぜMHCの遺伝型がもっとも強い遺伝的リスク要因なのかを説明できませんでした。一方、研究グループは、これまでに考えられてきたのとは異なる細胞内経路で自己抗原がMHCに提示されるという細胞の異常状態を発見し、このような異常な細胞でMHCに提示された自己抗原を「ネオセルフ」と命名しました。
研究の内容
本研究では、このネオセルフに対するT細胞の反応性を解析することで、MHCの機能異常によってMHCに提示されたネオセルフが全身性の自己免疫疾患の原因分子であることを発見しました。
ネオセルフの影響を調べるために、薬剤投与によって後天的にネオセルフの発現を誘導するマウスを樹立しました。成熟マウスにネオセルフの発現を誘導すると、ネオセルフに反応するT細胞が顕著に増殖し、様々な自己抗体の産生が認められる等、全身性の自己免疫疾患であるSLEと同様な自己免疫疾患を発症することを発見しました。さらに、ネオセルフを認識するT細胞には自己抗体の産生を誘導する病原性があることも判明しました。一方、生まれつきネオセルフを発現するマウスでは、ネオセルフに反応するT細胞がネオセルフに対して寛容状態になっているために、自己免疫疾患を発症しません(図1)。これらのことからネオセルフがMHCに提示されることで自己免疫疾患が引き起こされることが明らかになりました。
図1. 成熟マウスにネオセルフの発現を誘導すると、ネオセルフ応答性のT細胞が活性化した結果、自己抗体の産生が認められ、SLE様の自己免疫疾患を発症することが明らかになった。
次に、全身性の自己免疫疾患であるSLEの患者さんのT細胞のT細胞受容体(TCR)をシングルセル解析によって、網羅的な解析を行いました。その結果、先述のネオセルフの発現誘導マウスと同様に、SLE患者さんでもネオセルフに反応するT細胞が顕著に増殖していることが判明しました。その割合は活性化T細胞の10%にも達し、これは通常のウイルス等に対するT細胞の割合と比べても圧倒的に多く、SLEの病態においてネオセルフ応答性T細胞が中心的な役割を担っていることが明らかになりました(図2)。このことから、ネオセルフが全身性自己免疫疾患の原因分子であることが判明しました。
図2. SLE患者さんのT細胞をシングルセル解析にて網羅的に解析した結果、ネオセルフに反応するT細胞が活性化T細胞の10%程度までに顕著に増殖しており、ネオセルフがSLE患者の自己応答性T細胞の主要な標的分子であることが判明した。
EBウイルスはほとんどの成人に持続感染していますが、その再活性化頻度は個人個人で異なり、再活性化の頻度が高いことが、様々な自己免疫疾患の発症リスクになりますが、そのメカニズムについてはこれまで不明でした。本研究により、EBウイルスの再活性化によってMHCの機能異常が引き起こされ、ネオセルフがMHCに提示されることが判明しました。さらに、EBウイルスの再活性化によって誘導されたネオセルフは、SLE患者さんにおける自己応答性T細胞を活性化させ、自己免疫の引き金になっていることが明らかになりました。以上の結果から、T細胞は、従来の定説であった「自己(セルフ)と非自己(ノンセルフ)の識別」に加え、「自己(セルフ)とネオセルフの識別」能を有することが判明しました。自己免疫疾患においては、T細胞が自己(セルフ)とネオセルフを識別することで、本来自己の分子であるネオセルフに対する免疫応答が誘導された結果、自己免疫応答が誘導されていることが判明しました。また、ネオセルフの提示を引き起こす要因の一つとして持続感染ウイルスであるEBウイルスの再活性化がネオセルフの発現誘導を介して自己免疫応答を引き起こしていることが判明しました。(図3)。
図3. EBウイルスの再活性化によりMHCには異常な自己抗原であるネオセルフが提示される。その結果、T細胞は、自己の分子であるにも関わらず、ネオセルフを異物として認識してしまうことで、自己免疫応答が引き起こされ、自己免疫疾患は発症することが判明した。本研究により、これまでの免疫学の概念を変える新たな免疫細胞の認識機構が明らかになった。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、全身性自己免疫疾患であるSLEの発症機構を解明したと同時に、T細胞による新たな認識機構を発見した研究成果です。これまで、自己免疫疾患の原因が不明であるために、生物学的製剤を含めて対症療法薬しか存在しなく、長期にわたる投薬が必要でした。本研究により、全身性の自己免疫疾患の発症機構が明らかになったため、自己免疫疾患の発症機序を標的とした根治的治療の開発が期待されます。また、本研究によって明らかになった自己免疫疾患の発症機構はSLEばかりでなく、MHCが関与する他の様々な自己免疫疾患にも幅広く共通している可能性が考えられ、それらの疾患の根治的治療の開発にも応用が期待されます。
特記事項
本研究成果は、2024年9月14日(土)0時(日本時間)、2024年9月13日(金)11時(米国東部時間)に米国科学誌「Cell」に掲載されました。
タイトル:“Neoself-antigens are the primary target for autoreactive T cells in human lupus”
著者名:Shunsuke Mori1, Masako Kohyama1,2, Yoshiaki Yasumizu3,6, Asa Tada1, Kaito Tanzawa1,2, Tatsuya Shishido1,2, Kazuki Kishida2, Hui Jin2, Masayuki Nishide4, Shoji Kawada4, Daisuke Motooka5,6,7, Daisuke Okuzaki5,6,7, Ryota Naito2,8, Wataru Nakai1,2, Teru Kanda9, Takayuki Murata10,11, Chikashi Terao12,13,14, Koichiro Ohmura8,15, Noriko Arase16, Tomohiro Kurosaki17; Manabu Fujimoto16, Tadahiro Suenaga1,2,18, Atsushi Kumanogoh4,19, Shimon Sakaguchi3,20, Yoshihiro Ogawa21, Hisashi Arase1,2,19,22
所属
1. 大阪大学 免疫学フロンティア研究センター(IFReC) 免疫化学
2. 大阪大学 微生物病研究所(RIMD) 免疫化学分野
3. 大阪大学 免疫学フロンティア研究センター(IFReC) 実験免疫学
4. 大阪大学 大学院医学系研究科 呼吸器・免疫内科学
5. 大阪大学 微生物病研究所 ゲノム解析室
6. 大阪大学 先導的学際研究機構(OTRI) 生命医科学融合フロンティア研究部門
7. 大阪大学 免疫学フロンティア研究センター(IFReC) ヒト免疫学(単一細胞ゲノミクス)
8. 京都大学 大学院医学系研究科・医学科 臨床免疫学
9. 東北医科薬科大学 微生物学
10. 名古屋大学 大学院医学系研究科 微生物・免疫学講座 ウイルス学
11. 藤田医科大学 ウイルス学・寄生虫学
12. 理化学研究所(RIKEN) 生命医科学研究センター ゲノム解析応用研究チーム
13. 静岡県立総合病院 臨床研究部
14. 静岡県立大学 薬学部 ゲノム病態解析分野
15. 神戸市立医療センター中央市民病院 膠原病・リウマチ科
16. 大阪大学 大学院医学系研究科 皮膚科学
17. 大阪大学 免疫学フロンティア研究センター(IFReC) 分化制御
18. 北里大学医学部 免疫学
19. 大阪大学ワクチン開発拠点 先端モダリティ・DDS研究センター(CAMaD)
20. 京都大学医生物学研究所(LiMe)
21. 九州大学 大学院医学研究院 病態制御内科学(第三内科)
22. 大阪大学感染症総合教育研究拠点(CiDER)
DOI:https://doi.org/10.1016/j.cell.2024.08.025
本研究は、日本学術振興会科研費、日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST)免疫記憶の理解とその制御に資する医療シーズの創出、および、免疫アレルギー疾患実用化研究事業の一環として行われました。
参考URL
研究室ホームページ
https://immchem.biken.osaka-u.ac.jp
用語説明
- ネオセルフ
MHCクラスII分子は正常状態では、そのほとんどが自己の抗原由来のペプチドを提示しているが、その様な自己抗原ペプチドに対しては、免疫応答の司令塔であるヘルパーT細胞は寛容状態になっている。一方、MHCクラスII分子にウイルス等の非自己の分子由来のペプチドが提示されると、ヘルパーT細胞は異物として認識して攻撃する。研究グループは、MHCクラスII分子の抗原提示機構が障害を受けると、正常では提示されない自己抗原が提示されるようになることを発見し、その様な異常なMHCクラスII分子に提示された自己抗原をネオセルフと命名したものである。
- EBウイルス
成人の約90%が感染しているヘルペスウイルスの1種。潜伏感染と再活性化(ウイルス増殖)を繰り返しているが、その再活性化頻度は個人間で異なる。EBウイルスの再活性化が高頻度の認められる人では、様々な自己免疫疾患のリスクが高くなることが報告されている。
- MHC(主要組織適合性遺伝子複合体)
MHCは正常状態ではT細胞にペプチド抗原を提示することで、免疫応答の中心を担っている分子。ヒトではHLAと呼ばれる。特定の遺伝型のHLAは自己免疫疾患の発症リスクに最も強く影響を与えるヒト遺伝子であることから、自己免疫疾患の発症に関与する疾患遺伝子でもある。
- 全身性エリテマトーデス(SLE)
多彩な症状(発熱・全身倦怠感・関節痛・皮膚症状・内臓疾患)を引き起こす原因が不明な全身性自己免疫疾患である。細胞の核に対する抗体(抗核抗体)の産生、免疫複合体の組織への沈着を特徴とする。原因が不明であるために、対症療法薬の長期間の投薬が必要である。
- T細胞受容体(TCR)
T細胞が抗原を認識する際に使用する受容体で、個々のT細胞では異なる遺伝子配列の受容体を発現しており、それぞれのT細胞受容体がMHCに提示された抗原を特異的に認識する。T細胞受容体が抗原を認識するとT細胞へ刺激シグナルを伝達し、T細胞の増殖やサイトカインの産生を引き起こす。
- シングルセル解析
遺伝子発現を1細胞レベルで網羅的に解析する手法であり、本手法を利用することによりT細胞受容体遺伝子の解析が飛躍的に進んだ。
