免疫vsマラリア原虫
攻防の鍵を握るタンパク質RIFINの機能を解明。ワクチン開発にも期待
研究成果のポイント
概要
大阪大学微生物病研究所の迫口瑛史助教(研究当時)、荒瀬尚教授(免疫学フロンティア研究センター兼務)、岩永史朗教授らの研究グループは、英国・オックスフォード大学のMatthews K. Higgins教授との共同研究により熱帯熱マラリア原虫とナチュラルキラー細胞が、それぞれ感染赤血球表面タンパク質と受容体を介して、互いに認識し攻防することを明らかにしました。
これまで熱帯熱マラリア原虫は感染赤血球表面上のRIFINというタンパク質を使い、免疫細胞を抑制することが明らかとなっていましたが、ヒト免疫細胞側の応答や攻撃については不明でした。
今回、研究グループはRIFINがナチュラルキラー細胞の抑制化受容体を刺激してその機能を抑制する一方で、ナチュラルキラー細胞は活性化受容体を介して原虫感染赤血球を特異的に攻撃することを明らかとしました。さらに同定したRIFINと類似のRIFINは世界中の原虫株に存在し、原虫とヒトは共通の機構で攻防することを明らかとしました。これらのことより、ナチュラルキラー細胞の受容体と結びつくRIFINを標的とした新たなマラリアワクチンの開発が期待されます。
本研究成果は、米国科学誌「Nature」に、6月12日(木)0時(日本時間)に公開されました。
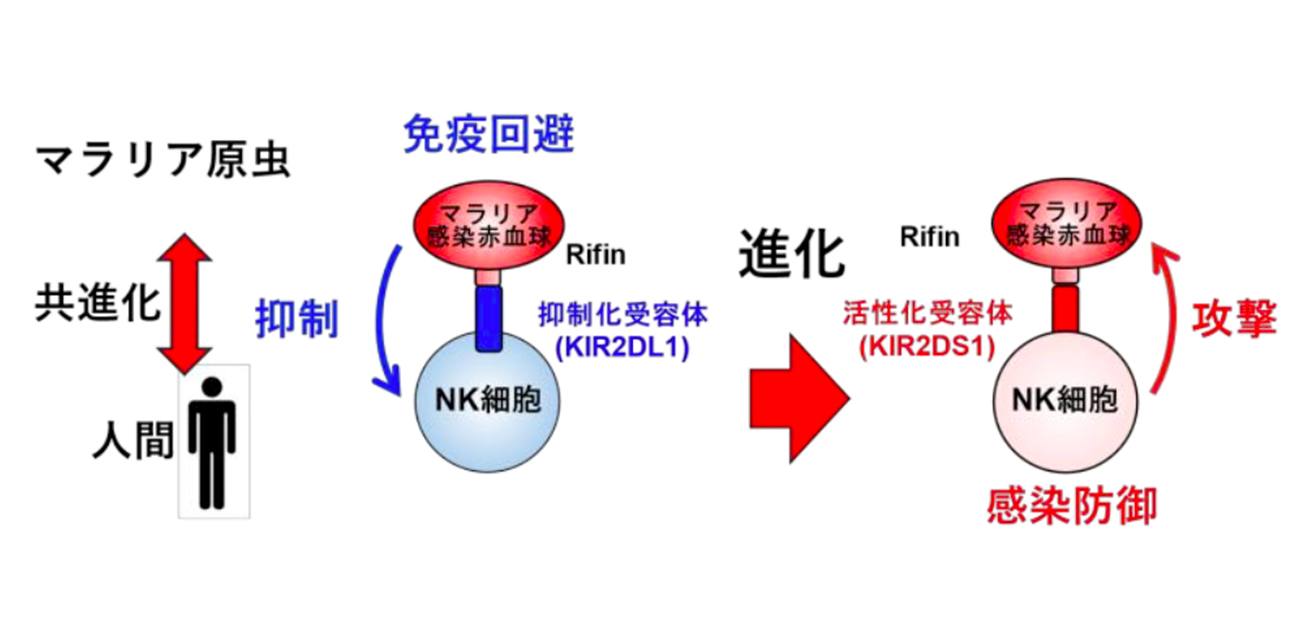
図1. ナチュラルキラー細胞と熱帯熱マラリア原虫との攻防
熱帯熱マラリア原虫はナチュラルキラー細胞の抑制化受容体KIR2DL1を利用して免疫応答から回避する。逆に我々人間は活性化受容体KIR2DS1を獲得することによってマラリア原虫に対する感染抵抗性を獲得した。
研究の背景
マラリアは有史以来、ヒトの生命に対する巨大な脅威です。現在、WHOにより世界三大感染症と認定され、2023年時点で世界83カ国で流行し約2.6億人の患者と約60万人の死者を出しています。2000年代以降、ノーベル賞に輝いたアルテミシニンという特効薬の使用により順調に死者数が減少してきましたが、2015年以降、減少は頭打ちし、新たな治療法・予防法による解決が求められています。マラリア被害の最大の問題は脳機能障害など重篤な症状を引き起こす熱帯熱マラリア原虫の感染です。この熱帯熱マラリア原虫は赤血球感染時に自身のタンパク質を赤血球表面へと輸送・発現し、これを使い、抗体からの攻撃回避や脳機能障害の原因である微小血管接着を引き起こします。RIFINは原虫の赤血球表面タンパク質の一種であり、原虫は一株あたり150~200種のRIFINを持ち、更にその構造は原虫株間で異なることから地球上には数億種類以上のRIFINが存在すると考えられます。これまでに研究ループは特定のRIFINがナチュラルキラー細胞・B細胞上の抑制化受容体を刺激して免疫を抑え、マラリア重症化を引き起こすことを報告してきました(Nature 2017)。
研究の内容
今回、研究グループは原虫による免疫抑制機構の更なる解明を目的に、熱帯熱マラリア原虫の感染赤血球と種々の抑制化受容体との結合を検討し、新たにナチュラルキラー細胞の抑制化受容体であるKIR2DL1を標的として同定しました。更にKIR2DL1に対する結合が新規なRIFINによることを突き止め、原虫がこのRIFINによりKIR2DL1を介してナチュラルキラー細胞の細胞傷害活性を抑制することを明らかにしました。また、マラリア流行地である東南アジア、アフリカ由来の原虫株においても同じ機能を持つRIFINが存在し、このRIFINが世界中に分布し、共通のメカニズムで免疫を回避することが示唆されました。一方、ナチュラルキラー細胞はKIR2DL1と類似の構造を持つ活性化受容体であるKIR2DS1を持っています。そこでRIFINによりナチュラルキラー細胞を刺激したところ、KIR2DS1を発現するナチュラルキラー細胞は特異的に細胞傷害活性を増強することが明らかとなりました。これらのことから原虫は特定のRIFINを使い、抑制化受容体KIR2DL1を介してナチュラルキラー細胞の細胞傷害活性を抑制して免疫システムから逃れ、逆にヒトは活性化受容体KIR2DS1を使って、このRIFINを認識し細胞傷害活性を活性化して感染赤血球を排除することが明らかとなりました。
図2. RIFINと抑制化受容体KIR2DL1の結合
本図は、Adapted from Sakoguchi et al., RIFINs displayed on malaria-infected erythrocytes binds both KIR2DL1 and KIR2DS1, Nature, 2025, Springer Nature掲載図をもとに一部改変しています。
図3. RIFINによるナチュラルキラー細胞の抑制
RIFINはKIR2DL1を発現するナチュラルキラー細胞の細胞傷害活性の活性化を顕著に抑制する(青色矢印)。
本図は、Adapted from Sakoguchi et al., RIFINs displayed on malaria-infected erythrocytes binds both KIR2DL1 and KIR2DS1, Nature, 2025, Springer Nature掲載図をもとに一部改変しています。
図4. RIFINによるナチュラルキラー細胞の活性化
KIR2DS1を発現するナチュラルキラー細胞はRIFINを特異的に認識して細胞傷害活性を活性化する(赤色矢印)。
本図は、Adapted from Sakoguchi et al., RIFINs displayed on malaria-infected erythrocytes binds both KIR2DL1 and KIR2DS1, Nature, 2025, Springer Nature掲載図をもとに一部改変しています。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、ナチュラルキラー細胞がマラリア感染時の免疫応答のフロントラインに存在し、原虫とナチュラルキラー細胞の攻防は多様な原虫株において共通して起きることが明らかとなりました。また、数億種以上存在するRIFINのうち、同定したRIFINと類似の機能を持つRIFINは原虫株間で共通に存在することから、これらを標的とすることで効果的なマラリアワクチンを開発できると期待されます。
特記事項
本研究成果は、2025年6月12日(木)0時(日本時間)に英国科学誌「Nature」(オンライン)に掲載されました。
タイトル:“RIFINs displayed on malaria-infected erythrocytes binds both KIR2DL1 and KIR2DS1”
著者名:Akihito Sakoguchi, Samuel G. Chamberlain, Alexander M. Morch, Marcus Widdenss, ThomasE. Harrison, Michael L. Dustin, Hisashi Arase, Matthews K. Higgins, and Shiroh Iwanaga
DOI:https://doi.org/10.1038/s41586-025-09091-y
なお、本研究は、AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業「ワクチン開発のための世界トップレベル研究開発拠点群大阪府シナジーキャンパス(大阪大学ワクチン開 発拠点)」(JP223fa627002)、AMED・CREST「免疫記憶の理解とその制御に資する医療シーズの創出」、JST・CREST「細胞を遊ぶ」研究助成事業、英国Welcome Trust研究助成事業の一環として行われました。
参考URL
SDGsの目標
用語説明
- 熱帯熱マラリア原虫
学名はPlasmodium falciparum。脳機能障害等の重篤な症状を引き起こし、マラリアによる死者の殆どが本原虫の感染に因る。
- RIFIN
熱帯熱マラリア原虫のrif (reoetitive interspersed family)遺伝子にコードされるタンパク質。原虫一株あたり約150~200種のRIFINが存在し、その全てが異なる。更に原虫株間でも全てのRIFINは異なっており、その総数は理論上、少なくとも数億種類以上存在する。
- ナチュラルキラー細胞
自然リンパ球の一種の細胞。強力な細胞傷害活性を持ち、抗原認識なしでウイルス感染細胞や腫瘍細胞を認識・排除する。
- 抑制化受容体
免疫細胞の表面に存在するタンパク質で、周囲の細胞や異物の情報を受け取るセンサー。抑制化受容体は免疫反応を抑制し過剰な免疫反応や自己免疫を防ぐ働きをする。
- 活性化受容体
抑制化受容体とは逆に、活性化受容体は免疫細胞を活性化し、サイトカイン産生など免疫応答がひきおこされる。
- KIR2DL1
主にNK細胞に発現する受容体でKIR2DL1は抑制化受容体である。リガンド結合を担う細胞外領域はKIR2DL1とKIR2DS1で極めて類似しており、共通の遺伝子から進化した受容体でペア型受容体である。
- KIR2DS1
主にNK細胞に発現する受容体でKIR2DS1は活性化受容体である。



