膵がん悪性化に関わるCKAP4を標的とする ヒト化抗体の開発に成功
膵がん新規治療法開発の可能性
研究成果のポイント
- 抗がん剤開発研究に用いてきた従来のマウス由来抗CKAP4抗体をもとに、ヒトへの投与が可能なヒト化抗CKAP4抗体の開発に成功した。
- CKAP4の過剰発現は膵がんの悪性化に関与することから、ヒト化抗CKAP4抗体が膵がんに対する新規治療薬となる可能性が示唆された。
概要
大阪大学感染症総合教育研究拠点の菊池章特任教授(常勤)、大学院医学系研究科医学科教育センターの佐田遼太助教らの研究グループは、独自に見出した、がん細胞の増殖を促進するDKK1-CKAP4シグナル経路を阻害するヒト化抗CAKP4抗体を開発することに成功しました。
我が国では、膵臓がん(膵がん)により毎年約3万8千人が死亡しています。膵がんは診断時に既に進行がんであることが多く、標準薬物療法として古典的抗がん剤による治療が行われるものの、長期的な予後は極めて不 良(5年相対生存率(2009~2011年):8.5 %です。膵がんに対する分子標的治療薬としてEGFRチロシンキナーゼ阻害剤エルロチニブが2011年に承認されましたが、治療効果は限定的であり、新規分子標的治療薬の開発が長年の社会的要請となっています。
研究グループは、これまでに膵がんにおいてDKK1-CKAP4シグナル経路が活性化されており、本経路の活性化が膵がんを悪性化することを見出しました。また、独自に開発したマウス抗CKAP4モノクローナル抗体が膵がん細胞の増殖を阻害することを、マウスを用いたモデル実験で示してきました。
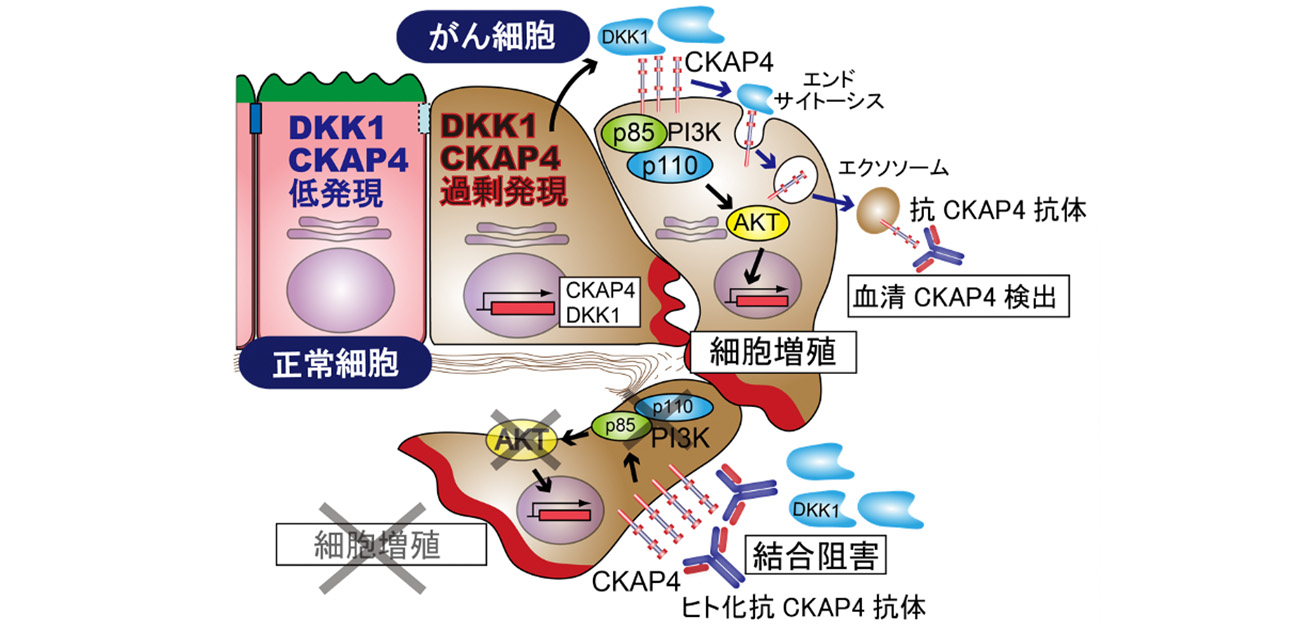
今回、研究グループはヒトへの投与を可能とするヒト化抗CKAP4抗体を新規に作製し、同抗体が単独でマウス膵がんモデルに対して抗腫瘍効果を示すことを明らかにしました。さらに、ヒト化抗CKAP4抗体が腫瘍微小環境において抗腫瘍免疫を増強する可能性を見出し、同抗体が膵がんに対する新たな治療法となる可能性を示唆しました(図1)。
本研究成果は、2024年8月8日(木)に「Cancer Science」誌(オンライン)に掲載されました。
図1. DKk1-CKAP4がんシグナル経路の概要とヒト化抗CKAP4抗体によるがん治療
研究の背景
Dickkopf1(DKK1)は細胞外分泌タンパク質で、種々のがん細胞の増殖を促進することが知られていましたが、長年にわたりその作用機構は不明でした。研究グループは、2016年にDKK1の細胞膜受容体としてCytoskeleton-Associated Protein 4 (CKAP4)を同定しました。DKK1がCKAP4に結合すると、PI3キナーゼ-AKT経路が活性化され、がん細胞増殖が促進される分子機構を明らかにしました。実臨床においても、膵がんと肺がん、食道がん、肝がんにおいて、DKK1-CKAP4シグナル経路が活性化されている症例は予後不良であることを、臨床データを用いた解析で明らかにしてきました。また、これらの難治がんのマウスモデルに対して、マウス抗CKAP4モノクローナル抗体が抗腫瘍効果を有することを示しました。
今回の研究では、マウス抗CKAP4抗体をヒト化した抗CKAP4抗体を新規に作製して、同抗体の膵がんマウスモデルに対する抗腫瘍効果を検討しました。
研究の内容
今回、研究グループはヒト化抗CKAP4抗体を開発するために、まずマウス抗CKAP4モノクローナル抗体(3F11-2B10)の塩基配列を決定して、その情報をもとに、定常領域と可変領域のフレームワークをヒト由来のものに置換し、ヒト化抗CKAP4抗体(Hv1Lt1)を作製しました。Hv1Lt1とCKAP4の細胞外領域との結合親和性を、表面プラズモン共鳴法を用いて測定すると、Hv1Lt1とCKAP4の結合親和性は0.76 nMであり、3F11-2B10の結合親和性(~10 nM)よりも高いことが判明しました。Hv1Lt1は、単独で膵がん細胞のスフェア形成能を阻害するとともに、膵がん標準治療薬であるゲムシタビンまたはナノ粒子アルブミン結合パクリタキセル(nab-PTX)と併用することにより相加的な阻害活性を示しました。
膵がん細胞を免疫不全マウス皮下に移植(皮下腫瘍モデル)し、Hv1Lt1を腹腔内に投与したところ、対照群と比較して腫瘍形成が30~50%抑制されました。さらに、Hv1Lt1とゲムシタビンまたはnab-PTXの併用により、皮下腫瘍モデルに対して相加的な腫瘍増殖抑制効果が認められました。非担がんの野生型マウスに、Hv1Lt1を週2回、3か月間腹腔内投与しましたが、投与期間中にマウスの体重減少や行動異常は認められず、主要臓器の肉眼的・組織学的所見並びに血液検査において異常は認められませんでした。
近年、様々ながんにおいて腫瘍微小環境(tumor microenvironment:TME)の抗腫瘍免疫が阻害され、結果として腫瘍形成が促進されることが明らかになっています。Hv1Lt1による抗腫瘍免疫に対する影響を検討するために、KPC膵がんモデルマウス(活性型Rasを発現させ、p53をヘテロ欠損させた膵がん誘導マウス)由来の膵がんオルガノイド(KPCオルガノイド)を樹立し、同オルガノイドにCKAP4とDKK1を発現させたオルガノイド(KPC/CKAP4/DKK1オルガノイド)を作製しました。KPC/CKAP4/DKK1オルガノイドを野生型マウスの膵同所に移植したところ、ヒト膵がんに類似した組織構造を示す膵腫瘍を形成することが確認されました。同マウス膵がんモデルに対してHv1Lt1を投与したところ、対照群と比較して膵腫瘍形成が抑制されました。
切除腫瘍のRNA-seq解析を行ったところ、階層的クラスタリングと主成分分析により、Hv1Lt1投与群と対照群は明瞭に別集団として分離され、パスウェイ解析ではHv1Lt1投与群で免疫応答に関連するシグナル経路の遺伝子発現の変化が認められました。さらに、Hv1Lt1投与群において腫瘍部へのCD8陽性(細胞傷害性)T細胞の浸潤が増強されました。以上の結果より、Hv1Lt1は抗腫瘍免疫を促進することが示唆されました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、新規に開発したヒト化抗CKAP4抗体Hv1Lt1が膵がん前臨床モデルに対する抗腫瘍作用を有することが示されました。マウス抗体からヒト化抗体を作製する際に、その薬効が減少したり、消失したりすることがしばしば起こりますが、Hv1Lt1はオリジナル抗体であるマウス3F11-2B10よりもCKAP4への結合親和性が高く、同等の薬効を示しました。また、Hv1Lt1を既存の膵がん標準治療薬と併用することで相加的な抗腫瘍効果を認めたことから、Hv1Lt1抗体併用化学療法が既存薬の投与量を減量し、有害事象を抑制する等の新たな治療戦略に繋がる成果と考えられます。さらに、Hv1Lt1投与によりCD8陽性T細胞の腫瘍部への浸潤が増強したことは、DKK1-CKAP4シグナル経路が腫瘍微小環境において抗腫瘍免疫応答を制御していることを支持する重要な知見であり、同シグナル経路の非細胞自律的な分子機構の解明に繋がる研究成果と考えられます。膵がんは抗腫瘍免疫応答に乏しく、がん免疫療法が奏功しない”immune cold”ながんの代表として知られています。膵がんの新規治療法の開発と臨床応用は喫緊の社会的課題であり、本研究成果がその端緒となることが期待されます。
特記事項
本研究成果は、2024年8月8日(木)に「Cancer Science」誌(オンライン)に掲載されました。
タイトル:“Newly developed humanized anti-CKAP4 antibody suppresses pancreatic cancer growth by inhibiting DKK1-CKAP4 signaling”
著者名:Ryota Sada, Hideki Yamamoto, Shinji Matsumoto, Akikazu Harada, and Akira Kikuchi
DOI:10.1111/cas.16278
なお、本研究は、日本医療研究開発機構(AMED)橋渡し研究の一環として行われました。
参考URL
SDGsの目標
用語説明
- DKK1-CKAP4がんシグナル経路
2016年に菊池章特任教授(常勤)らの研究グループが見出した新規がんシグナル経路。細胞外分泌タンパク質DKK1が細胞膜受容体CKAP4に結合すると、PI3キナーゼ-AKT経路が活性化され、がん細胞の増殖を促進します。膵がんと肺がん、食道がん、肝がんでDKK1とCKAP4の両タンパク質が高発現している症例は予後不良であることが判明しています。今回、DKK1-CKAP4がんシグナル経路を遮断するヒト化抗CKAP4抗体の開発に成功しました。
- 腫瘍微小環境
腫瘍組織において、腫瘍細胞周囲の存在する炎症細胞や免疫細胞、血管・リンパ管の構成細胞、線維芽細胞、線維組織等の集合体を意味します。腫瘍細胞の増殖、生存、浸潤、転移を制御して、がん幹細胞のニッチとしても機能します。
- 抗腫瘍免疫
腫瘍細胞は遺伝子変異の蓄積により形成されることから、免疫系がこれらの遺伝子変異に由来するタンパク質を非自己として認識することにより、腫瘍細胞の進展を阻止する仕組みを指します。近年、この宿主の悪性腫瘍に対する免疫応答を活性化するがん免疫療法が進展しています。


