スプライシング制御核酸医薬による 難治性がん治療の新しい選択肢
RESTを呼び起こし、がんを眠らせろ
お読みいただく前に
アンチセンス核酸医薬(ASO)などの核酸医薬は、低分子医薬や抗体医薬とは異なり、タンパク質の発現を遺伝子レベルで制御することから、次世代の分子標的医薬として注目されている。最近、スプライシング制御核酸医薬が医薬品として承認されているが、がん治療薬はまだ誕生していない。
研究成果のポイント
- 神経内分泌様がん(小細胞肺がん、治療抵抗性前立腺がん等)で発現する、腫瘍を抑制する転写因子「REST」の遺伝子について、その発現を促進する新たな核酸医薬、「スプライシング制御オリゴヌクレオチド(REST_SSO)」を開発。
- 神経内分泌様がんではRESTの発現が低下しているが、REST_SSOによってRESTのスプライシングを変化させることで、RESTの発現を高めた。さらに、がん細胞を移植したマウス腫瘍は、REST_SSOの投与により有意に縮小化した。
- 本研究成果により、REST_SSOを用いた新たな難治性がん治療薬開発の加速に期待。
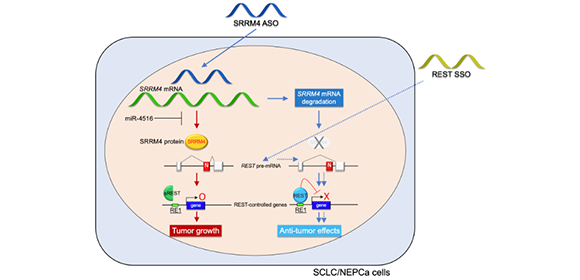
図1. REST_SSOの作用機序
REST_SSOは、エキソンNのスキッピングを誘導することで、神経内分泌様がん細胞で低下しているRESTの発現を上昇させて、がん細胞の生存率を低下させる。先行研究で開発中のSRRM4_ASOは、神経内分泌様がん細胞内で異常発現したSRRM4を低下させることでRESTの発現を促進して抗腫瘍効果を示したが、REST_SSOは、直接REST遺伝子の発現を促進することで抗腫瘍効果を示す。
概要
大阪大学大学院薬学研究科 生物有機化学分野の大学院生 三島 啓士朗さん(研究当時)、小比賀 聡教授、下條 正仁准教授(研究当時)は、難治性の神経内分泌がんに分類される小細胞肺がん及び治療抵抗性前立腺がんを治療標的とする新規の核酸医薬、スプライシング制御アンチセンスオリゴヌクレオチド(REST_SSO)の研究成果を報告しました。
神経内分泌様がん細胞内で異常発現しているタンパク質「SRRM4」は、RESTの発現を低下させる結果、RESTにより制御されるほとんどの神経遺伝子発現を促進させ、神経内分泌様がん細胞への分化と維持をもたらします。SRRM4に対するギャップマー型ASO(SRRM4_ASO)は、細胞内のSRRM4の発現を特異的に抑制し、腫瘍縮小を誘導しました引用1,2)。SRRM4_ASOの作用機序として、SRRM4の発現低下がRESTの発現を正常に誘導し、がん細胞の生存率を低下させることを報告しました引用3) 。すなわち、RESTの再発現を誘導することで、神経内分泌様がんに分化した細胞は生存率が低下することが示唆されました。研究グループは、RESTの発現を直接制御するREST_SSOの研究に着手し、抗腫瘍効果を示すREST_SSOの開発に成功しました。
研究の背景
死因の一位を占める肺がんの中でも、小細胞肺がんは進行が早い腫瘍です。最近、免疫チェックポイント阻害薬が承認されましたが、30年以上にわたり小細胞肺がんの効果的な新規治療薬の進展がありませんでした。また、治療抵抗性の前立腺がんや一部の乳がんも類似の形質を呈し、既存の治療薬が奏功しないなど治療抵抗性の問題があります。これらの難治性神経内分泌様がんでは、細胞内で腫瘍抑制因子REST(RE1-silencing transcription factor, 別名NRSF)の遺伝子が正常細胞とは異なるスプライシングとなっているため(sREST mRNA)、その結果、RESTの発現が低下しています (引用2) (図2)。
図2. REST遺伝子のスプライシング
通常、RESTはpre-mRNAのエキソン(E1-E4)から転写・翻訳されるが、SRRM4によりエキソンNが挿入されると、正常なRESTの発現が低下し、一方で異常なRESTであるsRESTの発現が亢進する。REST_SSOは、SRRM4などのスプライシング活性化因子の機能を競合的に阻害することでエキソンNのスキッピングを誘導し、正常なRESTの発現を増加させることで、がん細胞の生存率を低下させる。
研究グループは、小細胞肺がん(SCLC)や神経内分泌前立腺がん(NEPCa)で異常発現するSRRM4を標的とした革新的な核酸医薬、ギャップマー型SRRM4_ASOの開発研究を進めています 引用1,2)。SRRM4_ASOは、SRRM4 mRNAに特異的に結合し、細胞内のRNaseHによりSRRM4 mRNAを分解します。SRRM4_ASOがSRRM4の発現を抑制し、その結果RESTのスプライシング異常が改善されて、がん細胞の生存が抑制されたことによりSRRM4_ASOの抗腫瘍効果が示されました 引用3)。このことから神経内分泌様がんへ分化した細胞内においてRESTの発現を呼び起こすことが、がん細胞の生存を抑制することにつながる可能性に着目し、RESTのスプライシングを直接制御するREST_SSOの研究に着手しました。
RESTは、すべての神経遺伝子発現を制御する転写因子であり、中枢神経細胞とその他の細胞で発現様式が異なります。脳の細胞ではREST発現は低下して神経遺伝子が発現していますが、加齢とともに生じるRESTの発現により神経遺伝子発現が抑制される可能性も考えられます。一方で、肺や前立腺などの正常細胞ではRESTが高発現していますが、SCLCやNEPCaではRESTの発現低下が生じ、神経内分泌様がんへの分化が認められます。神経内分泌様がん細胞にRESTを強制発現させると細胞生存率の低下が生じることから、SCLCやPCaにおいてRESTの発現低下を正常に戻すことで、がん細胞死を誘導することを発見しました 引用3)。
研究の内容
REST遺伝子上に存在するマイクロエキソン(エキソンN)がスプライシングの過程で挿入されることで、sRESTの発現が増加してRESTの発現が低下します(図2)。スプライシング調節因子を競合的に阻害することでエキソンNの挿入を阻害する可能性のあるオリゴヌクレオチドを複数合成し、エキソンNを人為的に取り除くスキッピングを指標にスクリーニングを行うことで、REST_SSO(AmNA[+23/+40]及びAmNA[+27/+44])を取得しました。オリゴヌクレオチドには、小比賀教授が創出した人工修飾核酸AmNAを採用しており、標的配列への高い相補性を確保しました。このREST_SSOは、用量依存的にスプライシングを制御し、RESTの発現を高めました(図3)。
図3. REST_SSOは用量依存的にREST発現を促進する。
小細胞肺がん細胞に、REST_SSO(AmNA[+23/+40]及びAmNA[+27/+44])を添加すると、用量依存的にRESTスプライシングを制御し、RESTの発現を誘導した。RESTの発現は、図2に示したprimerを用いたPCR後、ゲル電気泳動にてREST及びsRESTのバンドの濃さを定量して評価した。
REST_SSOは、評価に用いたすべてのSCLC及びPCa細胞内でRESTの発現を亢進しました。 また、このスプライシング制御により、先行研究のSRRM4_ASOに匹敵する程度で、がん細胞の生存率を抑制しました(図4)。
図4. REST_SSOはSRRM4_ASOと同様に前立腺がん及び小細胞肺がん細胞の生存率を低下させた。
前立腺がん細胞(22Rv1及びVCaP)と小細胞肺がん細胞(NCI-N417及びNCI-H146)にREST_SSO(AmNA[+21/+40])を添加して、24時間ごとに細胞生存率を解析したところ、コントロール群と比較して細胞生存率が有意に低下した(左のグラフ)。導入試薬のみ(mock)、配列をランダムに合成したネガティブコントロール(NC)、及び先行研究のSRRM4_ASOはポジティブコントロールとして用いた。REST_SSOを添加しない場合に生存する細胞数を1として、72時間後の相対的生存率を示した(右のグラフ)。
がん細胞を移植したマウスにREST_SSOを投与したところ、コントロ―ル群と比較して、腫瘍サイズが有意に縮小しました。 肝毒性の指標として血中AST/ALT及び体重変化を評価したところ、大きな変化は認められなかったことから安全性は高いと考えられました。また、細胞内への取り込みを改善する目的で、cRGDをコンジュゲートしたREST_SSOをマウスに投与したところ、腫瘍内への移行と抗腫瘍効果に改善傾向が見られました(図5)。
がん細胞にREST_SSOを添加した後の遺伝子発現を網羅的に解析したところ、大きく変動した遺伝子のほとんどがRESTで制御される遺伝子でした。これは、がん細胞内でRESTの発現が誘導されたことにより、RESTで制御される遺伝子発現が抑制されたと考えられます。また、発現が亢進したmiRNAには、コンパニオン診断薬としての有効性を報告したmiR-4516引用2)が含まれており、個別化医療への治療薬開発に有効である可能性が高まりました。
図5. 前立腺がんを移植したマウス腫瘍に対してREST_SSO投与は抗腫瘍効果を示した。
(a)前立腺がん細胞(22Rv1)をマウスの背部に皮下移植し、REST_SSOを2日おきに4回投与して腫瘍サイズを測定したところ、REST_SSO投与群において腫瘍が有意に縮小した。(b)血中AST/ALT及び(c)体重に変化は見られなかった。 (d)最終日の腫瘍画像 (e)腫瘍内のREST_SSO定量解析
本研究成果が社会に与える影響(本研究成果の意義)
治療抵抗性が問題となっている小細胞肺がん、去勢抵抗性前立腺がん及び乳がんの新規治療薬の開発に向けて、本研究成果は大きく貢献することが期待されます。最近、同グループは核酸医薬をがん細胞内へ効率よく取り込ませる化合物L687を報告しており引用4)、両者の併用投与などの実用化に向けた検討をしています。今後、さらなる評価及び安全性を検証して、SRRM4_ASO及びREST_SSOは、それぞれの特徴を生かして実用化へつながると期待しています。
特記事項
研究成果は、国際科学誌Molecular Therapy Nucleic Acidsに、2024年7月2日午前11時 (協定世界時)/7月3日午前12時(日本時間) にオンライン版で発表されました。
タイトル:“Splice-switching antisense oligonucleotide controlling tumour suppressor REST is a novel therapeutic medicine for neuroendocrine cancer”
著者名:Keishiro Mishima, Satoshi Obika and Masahito Shimojo
DOI: https://doi.org/10.1016/j.omtn.2024.102250
本研究は、日本医療研究開発機構(AMED)「先端的バイオ創薬等基盤技術開発事業」、「創薬等先端技術支援基盤プラットフォーム(BINDS)」などの支援のもとで行われました。
引用情報
(1) 難治性肺がん治療に大きな前進となる新しい核酸医薬を開発! https://resou.osaka-u.ac.jp/ja/research/2019/20190619_1
(2) Shimojo M, Kasahara Y, Inoue M, Tsunoda SI, Shudo Y, Kurata T, Obika S. A gapmer antisense oligonucleotide targeting SRRM4 is a novel therapeutic medicine for lung cancer. Sci Rep 9, 7618 (2019) https://doi.org/10.1038/s41598-019-43100-1
(3) Yoshida M, Oda C, Mishima K, Tsuji I, Obika S, Shimojo M. An antisense amido-bridged nucleic acid gapmer oligonucleotide targeting SRRM4 alters REST splicing and exhibits anti-tumor effects in small cell lung cancer and prostate cancer cells. Cancer Cell Int 23, 8 (2023) https://doi.org/10.1186/s12935-022-02842-1
(4) Kohashi H, Nagata R, Tamenori Y, Amatani T, Ueda Y, Mori Y, Kasahara Y, Obika S, Shimojo M. A novel transient receptor potential C3/C6 selective activator induces the cellular uptake of antisense oligonucleotides. Nucleic Acids Res 52, 4784 (2024) https://doi.org/10.1093/nar/gkae245
参考URL
薬学研究科 生物有機化学分野
http://www.phs.osaka-u.ac.jp/homepage/b007/index.html
SDGsの目標
用語説明
- 核酸医薬
標的とするRNA (mRNA、pre-mRNAなど) に対して相補的な塩基配列を有する人工合成した核酸分子であり、標的RNAに結合して機能の制御を行う。既存の低分子医薬や抗体医薬では標的にすることが難しい細胞内のRNAを直接標的にすることが可能であり、次世代の医薬品として注目されている。
- スプライシング
DNAから転写されたpre-mRNAに含まれるタンパク質合成に必要なエキソンを連結する反応。遺伝子が正しく機能する上で最も重要な反応の一つ。

