中枢神経を標的とした核酸医薬の高い有効性と安全性を有する技術開発に成功
アルツハイマー型認知症などの神経難病治療の新たなる選択肢
研究成果のポイント
- アンチセンス核酸医薬(ASO) は、神経難病に対する新たな治療手段として期待されていますが、多くの疾患への応用には副作用のため投与量に制限があることが大きな障害となっています。
- 本研究グループは、核酸医薬の有効性を保ちつつ、神経系の副作用を著しく改善する新規の核酸化学修飾技術を見出しました。
- 本研究成果は、根治治療の難しい神経難病に対する高い有効性と安全性を兼ね備えた治療薬開発への応用が期待できます。
概要
東京医科歯科大学 大学院医歯学総合研究科 脳神経病態学分野の横田隆徳教授、吉岡耕太郎特任助教、Su Su Lei Mon特任研究員、松林泰毅大学院生らの研究グループは、大阪大学 大学院薬学研究科 生物有機化学分野の小比賀聡教授らのグループとの共同研究で、核酸塩基を修飾した糖部架橋型核酸「BNAP-AEO」による新規の核酸化学修飾技術を新たに導入したASOを、マウスを用いて検証したところ、高い有効性を保持しつつ重篤な神経系の副作用を劇的に改善することを明らかにしました。さらに、研究グループはその副作用改善のメカニズムを検証し、脳内に存在するSigma-1受容体の関与を示唆する結果を得ました。本研究は、国立研究開発法人日本医療研究開発機構(AMED)「先端的バイオ創薬等基盤技術開発事業」、「次世代治療・診断実現のための創薬基盤技術開発事業(RNA標的創薬技術開発)」、「脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)」、国立研究開発法人科学技術振興機構(JST)「創発的研究支援事業(JPMJFR216H)」、日本学術振興会(JSPS)「科研費助成事業(基盤研究(B)JP22H02979)」などの支援のもとで行われたので、その研究成果は、国際科学誌Molecular Therapy - Nucleic Acidsに、2024年3月18日午前11時(米国東部時間)にオンライン版で発表されました。
研究の背景
核酸医薬は次世代の分子標的医薬として注目され、最近は、脳や脊髄といった中枢神経の疾患を中心に臨床開発が急速に進んでいます。特に小児の神経難病の一つである脊髄性筋萎縮症を対象としたASOは日本を含む60カ国以上で承認され、2023年には特定の遺伝子変異がある筋萎縮性側索硬化症を対象としたASOもアメリカで迅速承認されました。このようなASOの開発動向を受けて、「神経難病が治る時代」への期待が大きくなっています。
中枢神経の疾患を対象としたASOは、中枢神経組織の周囲の空間である髄腔内へ投与することが一般的です。一方で、ASOの開発段階で大きな障害として、髄腔内に投与した際に痙攣(けいれん)や意識障害、運動機能の異常といった副作用が出現することが挙げられます。この結果、特に有効性が高い有望な候補品が副作用のために投与量に制限が生じてしまい、結局十分な有効性を引き出せない問題が存在しました。さらに、核酸医薬は一人一人の遺伝子の異常に応じて薬物の設計が可能であるため、超希少疾患と呼ばれるような患者数が非常に少ない遺伝性疾患に関しても個別の創薬開発が注目されています。しかし、そのような個別化治療のための創薬開発には候補薬の選別に時間的・金銭的にも大きな制約が存在し、有効性と安全性の両立する候補品を見出すことは容易ではありませんでした。
以上から、中枢神経の疾患を標的とした核酸医薬の臨床応用には、有効性と安全性の両立を可能とする新たな技術の開発が望まれていました。そこで、本研究グループは大阪大学の大学院薬学研究科の小比賀聡教授らのグループが開発した新規の核酸化学修飾技術を用いて、中枢神経疾患を標的としたASOの有効性及び安全性の詳細な検証に着手しました。
研究の内容
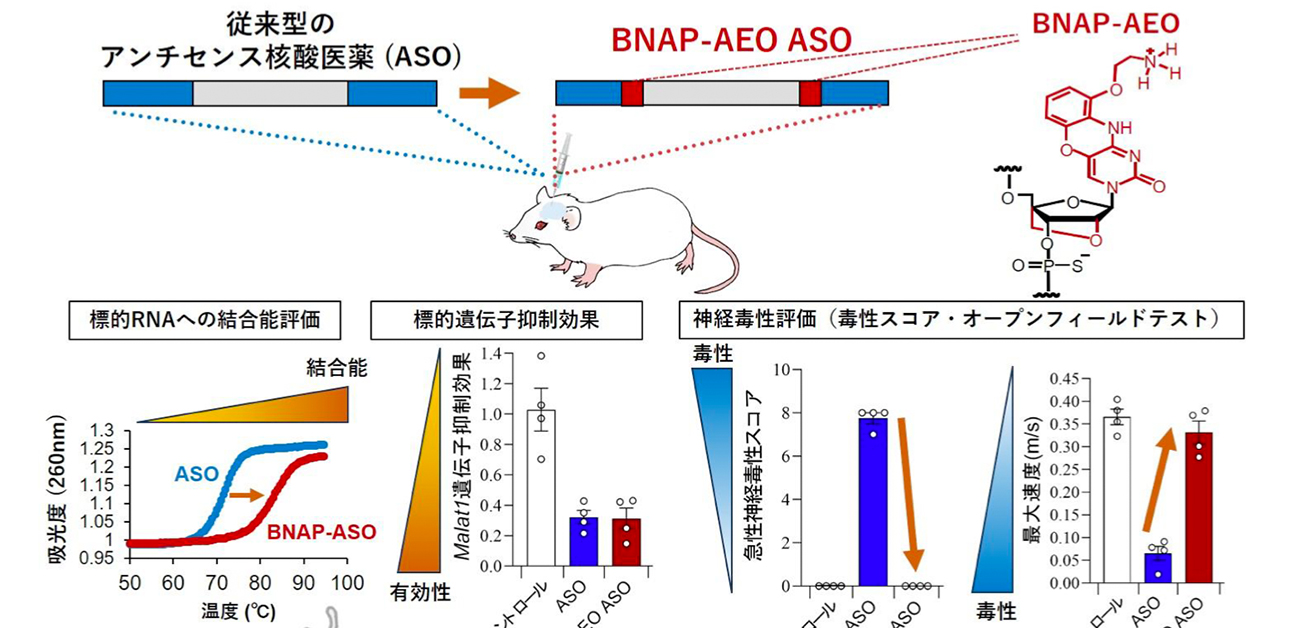
本研究グループは、まず従来型の化学修飾で高活性であるASO及びそのASOにBNAP-AEOを導入した新規ASO(BNAP-AEO ASO)を設計・合成しました(図1上段)。続いて、標的RNAに対する結合能を評価したところ、BNAP-AEO ASOは従来型のASOに比較して、結合能が極めて高いことを明らかにしました(図1中段左)。次に、これらASOをマウスの脳室と呼ばれる脳周囲の髄腔内に投与し、有効性及び安全性の検証を行いました(図1中段右)。その結果、BNAP-AEO ASOの脳内における標的遺伝子抑制効果は、従来型のASOと同様に高く保持されていました。さらに、神経機能の異常をスコア化した毒性スコアや自発的運動機能を測定するオープンフィールドテストを用いて投与後の神経機能を評価したところ、驚くべきことに従来型のASOで出現するマウスの重篤な神経毒性をBNAP-AEO ASOが劇的に改善することが明らかになりました。以上から、BNAP-AEO ASOは高い有効性、安全性を有することが分かりました(図1下)。
図1. BNAP-AEO ASOは高い有効性及び安全性の両立を可能にする
従来型のASO及び、BNAP-AEO修飾を導入したASO(BNAP-AEO ASO)を設計・合成しました(上段)。BNAP-AEO ASOは従来型のASOと比較して、標的RNAへの結合能が高く(中段左)、それぞれをマウスの髄腔内に投与した際の標的遺伝子への抑制効果は保持されつつ、毒性スコア評価・5分間の自発的運動機能評価(オープンフィールドテスト)において神経毒性が著しく改善しました(中段右)。つまり、BNAP-AEOは高い標的RNAへの結合能・有効性及び安全性を同時に可能としました。
さらに、本研究グループはBNAP-AEO ASOが神経毒性を改善した機序の解明に着手しました。従来型のASOは、神経細胞表面上のカルシウムチャネルの機能を阻害して細胞内のカルシウムイオンが低下されることで、急性の神経毒性が出現すると想定されています(図2左)。一方で、神経細胞に発現するSigma-1受容体は細胞内のカルシウムイオン濃度を調整する役割があること、Sigma-1受容体の活性化剤とBNAP-AEOが構造的に類似することに着目し、BNAP-AEO修飾がSigma-1受容体を介して神経毒性を改善させるのではないかという仮説を立てました。仮説検証のため、Sigma-1受容体の拮抗薬を従来型ASO及びBNAP-AEO ASOに併用してマウスに投与し、それらASOの神経毒性への影響を評価しました。その結果、Sigma-1受容体の拮抗薬の併用により、従来型のASOでは神経毒性が変化しなかった一方で、BNAP-AEO ASOは改善していた神経毒性が再び出現するようになりました。つまり、BNAP-AEOの導入による神経毒性の改善にはSigma-1受容体を介した細胞内カルシウム濃度調節によるメカニズム(図2右)が示唆される結果を得ました。
図2. BNAP-AEOによる神経毒性が改善する分子メカニズム仮説
従来型のASOは神経細胞内のカルシウムチャネルの機能を阻害して、細胞内のカルシウムイオンを低下させるため、急性神経毒性が出現します(左)。一方で、BNAP-AEO ASOはSigma-1受容体を介して、細胞内のカルシウムイオン低下を防ぎ、毒性が回避されることが想定されます(右)。
研究成果の意義
本研究グループは、BNAP-AEO修飾を導入したASOが、高い有効性と安全性を兼ね備えていることを明らかにしました。核酸医薬は中枢神経の疾患を中心に創薬開発が精力的に行われており、パーキンソン病や筋萎縮性側索硬化症、ハンチントン舞踏病といった神経難病やアルツハイマー型認知症といった頻度の多い神経疾患に対して臨床試験が進んでいます。また、本研究で開発した新規の核酸化学修飾はシトシン塩基配列を有するアンチセンス核酸に広く応用することが可能であり、高い有効性及び安全性の両立という臨床応用への重要な課題を克服することが期待されます。そのため、本研究の成果は多くの神経疾患の核酸医薬の治療開発のブレイクスルーに繋(つな)がる可能性を秘めており、本研究の成果を基に有効性及び安全性を両立する核酸医薬の基盤技術が確立することで、多様な神経疾患の治療法開発の成功に結びつくことが期待されます。
特記事項
【論文情報】
掲載誌:Molecular Therapy - Nucleic Acids
論文タイトル:Favorable Efficacy and Reduced Acute Neurotoxicity by Antisense Oligonucleotides with 2',4'-BNA/LNA with 9-(aminoethoxy)phenoxazine
SDGsの目標
用語説明
- アンチセンス核酸医薬(ASO)
標的とするRNA(mRNA、pre-mRNA、microRNAなど)に対して相補的な塩基配列を有した人工合成した核酸分子で、それらに標的RNAに結合して機能の制御を行う。既存の低分子医薬や抗体医薬では標的にすることが難しい細胞内のRNAを直接標的にすることが可能であり、次世代の医薬品として注目されている。
- 2',4'-BNA/LNA with 9-(aminoethoxy)phenoxazine (BNAP-AEO)
大阪大学の小比賀聡教授、中川治博士らが開発した新規の核酸分子の化学修飾技術。核酸糖骨格部に対する化学修飾である2',4'-BNA/LNAと、塩基に対する化学修飾である9-(aminoethoxy)phenoxazineを組み合わせた技術である。本研究グループはBNAP-AEOを導入した核酸分子は、標的RNAへの高い結合能を有することを報告している。
- Sigma-1受容体
脳内の特に神経細胞に多く発現する二回膜貫通型タンパク質。細胞内のカルシウムイオン濃度の調製や小胞体ストレス経路の活性化、ミトコンドリア機能の強化など様々な機能を有することが示されています。


