ハンセン病を起こすらい菌が マクロファージを攪乱する仕組みを発見
潜伏するらい菌を「可視化」して排除する抗菌薬の開発に期待
研究成果のポイント
- らい菌がなぜ宿主免疫を逃れ、潜伏しているのかが明らかとなった。
- その理由は、免疫賦活脂質(今回新たに発見)を素早く失活させる経路の獲得であった。
- この経路を阻害できれば、本来備わる免疫系による効率的ならい菌の排除が期待できる。
概要
大阪大学微生物病研究所の山崎晶教授 (免疫学フロンティア研究センター、感染症総合教育拠点兼務)、Jeroen Codée教授 (ライデン大学) の研究グループは、らい菌に含まれるフェノール糖脂質-III (PGL-III) が自然免疫を活性化することを明らかにしました。
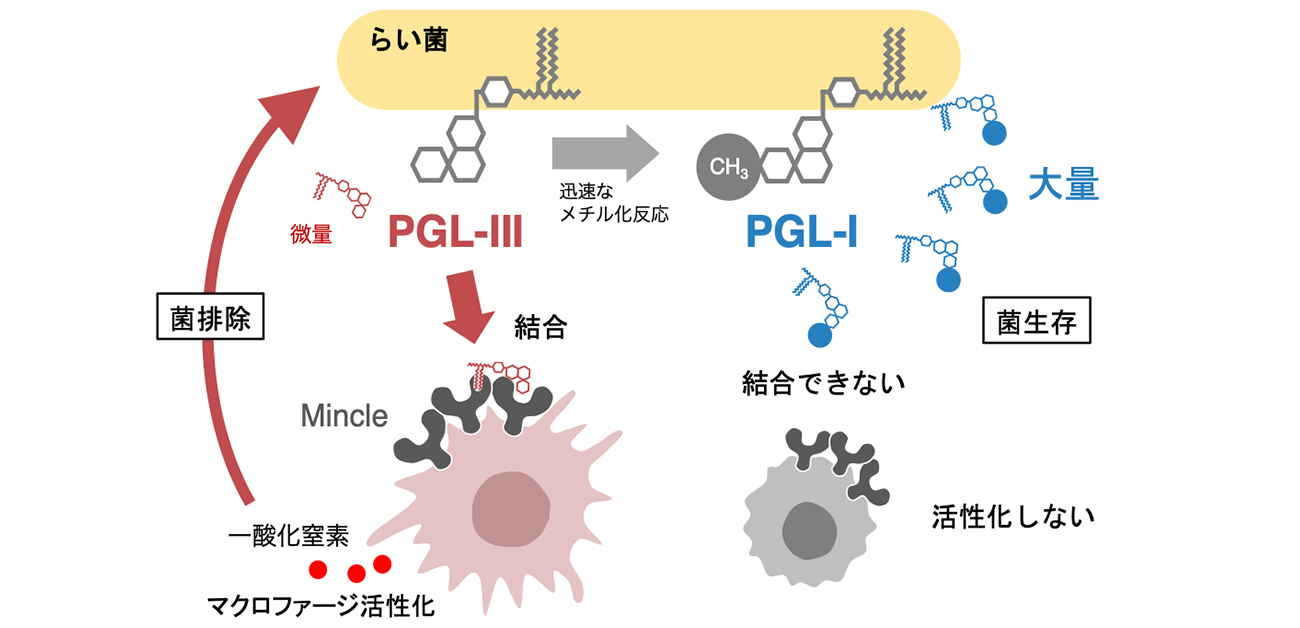
このPGL-IIIはらい菌に少量しか含まれないのに対して、PGL-IIIを中間体として生合成される免疫抑制成分PGL-I (フェノール糖脂質-I)は大量に存在します。らい菌はPGL-IIIを素早い酵素反応によりPGL-Iに変換することで、宿主免疫による攻撃を免れていると考えられます (図1)。
本研究成果は、米国科学誌 “ACS Central Science” に、7月12日(水)21時 (日本時間) に公開されました。
図1. らい菌の免疫逃避戦略
らい菌は免疫賦活能を有する代謝中間体(PGL-III)を素早く最終生成物(PGL-I)に変換しているために宿主免疫の攻撃を受けづらいと考えられる。
研究の背景
ハンセン病は古くから恐れられてきた感染症です。原因菌であるらい菌の免疫応答を起こしにくい性質が潜伏感染や持続感染に寄与していると考えられています。らい菌が免疫を抑制する成分を持っていることは、これまでの長年の研究で明らかになっていましたが、その一方で、らい菌が隠し持っている、免疫を活性化する成分に関する研究は十分に進んでいませんでした。
研究の内容
らい菌が持つ免疫活性成分と受容体の同定
らい菌が有する微量成分フェノール糖脂質-III (PGL-III) が活性型受容体であるmacrophage-inducible C-type lectin (Mincle) に反応することを明らかにしました。PGL-IIIは、PGL-Iの合成経路の中間体であることが分かっていましたが、機能は発見から40年間分かっていませんでした。
MincleのPGL-III認識様式の解析
さらにPGL-IIIが既知のMincleリガンドであるトレハロースジミコール酸 (TDM) を上回るリガンド活性を有することを見出しました (図2A)。MincleとPGL-IIIの複合体の構造解析からは、PGL-IIIが、あたかも「かすがい」のように2つのMincleを跨いで結合することで、効率よいMincleの重合化、細胞の活性化に寄与すると考えられました (図2B)。
図2. PGL-IIIはMincleの強力なリガンドである
A. PGL-IIIによる刺激では急峻な活性上昇が観察され「正の協同性」があることが示唆された。
B. PGL-IIIは2か所で別々のMincleと結合し、効率良い重合化シグナルを惹起すると考えられた。
らい菌感染におけるMincleの役割の解析
国立感染症研究所 感染制御部の阿戸学博士のグループとの共同研究により、Mincleを持たないマウスでは、らい菌に対する抵抗性が低下することが分かりました (図3)。このマウスでは一酸化窒素と呼ばれる抗菌物質を作り出す酵素の発現が低いことが分かりました。
図3. Mincleはらい菌感染に対して防御効果を示す
Mincleを持っているマウスと持たないマウスにらい菌を感染させ、1年後の感染部位の菌量を比較したところ、Mincleを持たないマウスでらい菌(紫色に染色されている)が多かった。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、近年増加している薬剤耐性らい菌に対抗する、新しいメカニズムをもつ抗らい菌薬の開発が期待されます。らい菌が持つ、PGL-IIIから PGL-Iに変換する酵素のはたらきを弱める薬剤がらい菌の「可視化」に有効であると考えられます。
特記事項
本研究成果は、7月12日(水)21時 (日本時間)に米国科学誌 “ACS Central Science”(オンライン) に掲載されました。
タイトル:“PGL-III, a rare intermediate of Mycobacterium leprae phenolic glycolipid biosynthesis, is a potent Mincle ligand”
著者名:Shigenari Ishizuka#, J. Hessel M. van Dijk#, Tomomi Kawakita, Yuji Miyamoto, Yumi Maeda, Masamichi Goto, Guillaume Le Calvez, L. Melanie Groot, Martin D. Witte, Adriaan J. Minnaard, Gijsbert A. van der Marel, Manabu Ato, Masamichi Nagae, Jeroen D. C. Codée, and Sho Yamasaki (#Equally contributed)
DOI:https://doi.org/10.1021/acscentsci.3c00040
なお、本研究は、AMED「新興・再興感染症に対する革新的医薬品等開発推進研究事業 (宮崎班・星野班・鈴木班)」「新興・再興感染症研究基盤創生事業 (他分野融合研究領域) (深野班)」、AMED-SCARDA「革新的アジュバント・ワクチンキャリアの開発と技術支援ならびにデータベースの構築 (國澤班)」、AMED-CREST「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」、大阪大学感染症総合教育研究拠点 (CiDER)、CaMAD「ワクチン開発のための世界トップレベル研究開発拠点の形成事業」、JSPS科研費基盤研究(C)「ハンセン病神経障害への電気刺激による神経筋再生治療と評価システムの開発」、オランダ科学研究機構 TOP-PUNT grantsの支援を得て、ライデン大学、国立感染症研究所、鹿児島大学、フローニンゲン大学との共同研究チームによって実施されました。
参考URL
用語説明
- らい菌
ハンセン病の原因菌。結核菌などと同じ抗酸菌群に属し、その中でもとりわけ免疫応答を起こしにくい。感染力は低いものの、感受性の高い宿主にひとたび感染すると、免疫による排除を受けにくく、持続感染や潜伏感染を引き起こす。
- PGL-I (フェノール糖脂質-I)
らい菌特有の糖脂質の一つで、菌体に含まれる割合が非常に高い。免疫を抑制する作用に加えて、ハンセン病に特徴的な神経障害を引き起こす要因であると言われている。
- ハンセン病
らい菌の感染によって皮膚や神経が侵される疾患。未治療の場合、不可逆的な運動障害や神経障害にまで発展する。病状の進行は概して緩慢に進行するが、とくに抗菌薬による治療中・治療後に急性の炎症反応である「らい反応」が起きることがある。
- macrophage-inducible C-type lectin (Mincle)
自然免疫を活性化する受容体の一つ。結核菌がもつトレハロースジミコール酸 (TDM) などの抗酸菌糖脂質を認識し、免疫応答を引き起こすことが報告されている。
