COVID-19ワクチン3回目接種によりオミクロン中和抗体が産生される仕組みを解明
抗体フィードバックメカニズムによる記憶B細胞産生制御
研究成果のポイント
- mRNAワクチン接種者検体より、新型コロナウイルス抗原特異的B細胞を解析
- 2回目接種まででは十分に産生されないオミクロン変異株中和抗体が、3回目接種により強く誘導される仕組みを解明
- 免疫記憶の誘導には抗体フィードバックメカニズムが関与している可能性を示した
概要
大阪大学免疫学フロンティア研究センター(IFReC)分化制御研究室の井上毅特任准教授(常勤)、黒﨑知博特任教授(常勤)らの研究グループは、新型コロナウイルスmRNAワクチン接種者検体より、新型コロナウイルス抗原特異的B細胞の解析を行いました。個々のB細胞が産生する抗体の性質を詳細に解析した結果、2回目ワクチン接種前と3回目ワクチン接種前の記憶B細胞の性能は大きく異なっており、2回目接種後に時間を経た体内には性質を変化させた記憶B細胞が蓄積していることが分かりました。
B細胞、T細胞といったリンパ球は、細菌・ウイルスなどの微生物感染において、生体防御反応の中心的役割を担います。ウイルスの2度目の侵入時には、最初の感染時につくられた記憶B細胞が素早く抗体を産生する細胞に分化し、効果的に抗原をブロック・除去します。この仕組みを利用して、感染前に免疫記憶を人為的に誘導するのがワクチン療法です。
これまで、2回のmRNAワクチン接種で誘導される抗体は、オミクロン変異株に対してほとんど中和活性をもたない一方、3回目接種で誘導される抗体は強い中和活性を示すことが知られていましたが(図1)、その原因は不明でした。
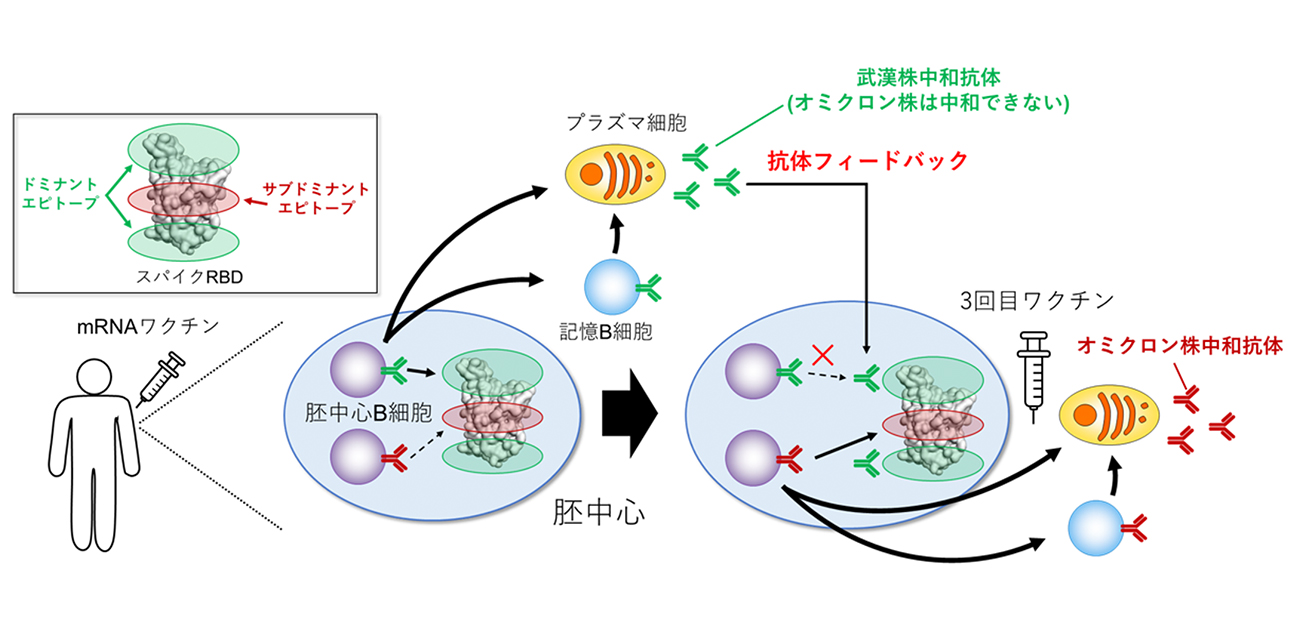
今回、研究グループは、ワクチン接種者のB細胞を1細胞ずつ解析することにより、3回目接種前の記憶B細胞はウイルス抗原への親和性が向上しているだけでなく、抗原を認識している場所(エピトープ)も変化しており、3回目接種時にはこの記憶B細胞がオミクロン変異株も中和できる抗体を産生していることを突き止めました。さらにマウスを使った実験から、ワクチン接種によって産生された抗体が記憶B細胞の質の変化に影響を与えている可能性を示しました(図2)。
本研究成果は、ワクチンによって誘導される複雑な免疫記憶の仕組みの一端を明らかにしたものであり、今後のワクチンデザインのための基盤となると期待されます。
本研究成果は、2022年12月13日に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されました。
図1. mRNAワクチン接種による血中抗体のウイルス中和活性
図2. 抗体フィードバックによる記憶B細胞のエピトープ変化によって、3回目接種後にオミクロン株中和抗体が産生される
研究の背景
COVID-19 mRNAワクチン(ファイザー社およびモデルナ社)の2回接種後、3回接種後ではいずれもオリジナルの武漢株に対する中和抗体が強く誘導されます。しかし、オミクロン変異株は感染に重要なスパイクタンパク質に多くの変異を有しており、2回接種後に誘導される抗体はオミクロン株に対してほとんど中和活性をもちません。いっぽう、3回接種後に誘導される抗体は強い中和活性を示すことが知られていましたが、その原因は不明でした(図1)。
研究の内容
研究グループは、新型コロナウイルスmRNAワクチン接種者検体より、新型コロナウイルス抗原特異的B細胞の解析を行いました。個々のB細胞を1細胞ずつ単離し、それらが産生する抗体を作製して性質を詳細に解析した結果、2回目ワクチン接種前と比較して3回目ワクチン接種前の記憶B細胞が産生する抗体は、抗原に対する親和性が上昇しているだけでなく、抗原を認識する場所(エピトープ)が変化していることが分かりました。
ウイルスのスパイクタンパク質のRBD領域にはB細胞が応答しやすい場所(ドミナントエピトープ)と応答しにくい場所(サブドミナントエピトープ)が存在しており、2回目接種前までではドミナントエピトープを認識する記憶B細胞が主に誘導されていました。このドミナントエピトープにはオミクロン株で変異が多く蓄積しており、このエピトープを認識する抗体はオミクロン株を中和できません。しかし3回目接種前の血中には、サブドミナントエピトープを認識する記憶B細胞の割合が増加しており、このエピトープを認識する抗体は、オミクロン株に対しても結合能、中和活性をある程度保持していることが分かりました。これらが3回目ワクチン接種で活性化されることでオミクロン株を中和できる抗体が血中に産生されると考えられます(図2)。
次にこのエピトープの変化をもたらす原因が、血中抗体のフィードバック機構によるものという仮説を立て、マウスを用いた実験を行いました。マウスにスパイクRBD抗原を免疫した後、血中抗体価を増加、あるいは減少させる実験を行ったところ、血中抗体価を増加させるとオミクロン株反応性B細胞の割合が増加し、反対に血中抗体価を減少させるとオミクロン株反応性B細胞の割合が減少することが分かりました。この結果は免疫後に産生された抗体が記憶B細胞のエピトープを変化させうることを示唆しており、ワクチン接種者においても産生された抗体が記憶B細胞の質の変化に影響を与えている可能性が考えられます。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果は、ワクチンによって誘導される複雑な免疫記憶の仕組みの一端を明らかにしたものであり、今後のワクチンデザインのための基盤となると期待されます。
特記事項
本研究成果は、2022年12月13日に米国科学誌「Journal of Experimental Medicine」(オンライン)に掲載されました。
タイトル:“Antibody feedback contributes to facilitating the development of Omicron-reactive memory B cells in SARS-CoV-2 mRNA vaccines”
著者名:Takeshi Inoue1, Ryo Shinnakasu1,2,3, Chie Kawai1, Hiromi Yamamoto1, Shuhei Sakakibara4, Chikako Ono5,6, Yumi Itoh7, Tommy Terooatea8, Kazuo Yamashita8, Toru Okamoto7, Noritaka Hashii9, Akiko Ishii-Watabe9, Noah S. Butler10, Yoshiharu Matsuura5,6, Hisatake Matsumoto11, Shinya Otsuka12, Kei Hiraoka12, Takanori Teshima13,14, Masaaki Murakami15,16,17 and Tomohiro Kurosaki1,18,19* (*責任著者)
DOI:https://doi.org/10.1084/jem.20221786
所属:
1. 大阪大学免疫学フロンティア研究センター 分化制御
2. 愛媛大学学術支援センター 医科学研究支援部門
3. 愛媛大学医学部付属病院 先端医療創生センター
4. 大阪大学免疫学フロンティア研究センター 免疫機能統御学
5. 大阪大学微生物病研究所 ウイルス制御学
6. 大阪大学感染症総合教育研究拠点 ウイルス制御学
7. 大阪大学微生物病研究所 高等共創研究院
8. KOTAIバイオテクノロジーズ株式会社
9. 国立医薬品食品衛生研究所 生物薬品部
10. Department of Microbiology and Immunology, The University of Iowa, USA
11. 大阪大学医学部附属病院 高度救命救急センター
12. 国立病院機構函館病院
13. 北海道大学病院 検査・輸血部
14. 北海道大学大学院医学研究院 血液内科学
15. 北海道大学 大学院医学研究科 分子神経免疫学
16. 量子科学技術研究開発機構 量子生命科学研究所 量子免疫学研究チーム
17. 自然科学研究機構 生理学研究所 分子神経免疫研究部門
18. 大阪大学感染症総合教育研究拠点
19. 理化学研究所 生命医科学研究センター 分化制御研究チーム
なお、本研究は、日本学術振興会科学研究費助成事業、日本医療研究開発機構、科学技術振興機構などの支援により行われました。
用語説明
- 抗体フィードバック
抗体はB細胞が活性化し、抗体産生細胞に分化して産生されるが、その産生された抗体自体がB細胞応答に影響を与える現象。
- 記憶B細胞
病原体への感染やワクチン接種など、抗原に感作されたときにつくられるB細胞。体内に長期間生存し、記憶していた抗原の再刺激を受けると、迅速に抗体産生細胞に分化して多量の抗体をつくる。
- エピトープ
抗体が認識して結合する抗原上の特定の部位。
- スパイクタンパク質
新型コロナウイルスは、ウイルス粒子表面に存在するスパイクタンパク質を介して標的細胞に結合する。mRNAワクチンは、スパイクタンパク質を体内で発現するように設計されている。
- RBD領域
RBD領域(受容体結合領域:Receptor Binding Domain)は、スパイクタンパク質中に存在する、細胞の受容体へ結合する領域。
