切断されたDNAをつなぎ直す、細胞の初動対応を解明
抗がん剤耐性細胞の生成の仕組みや免疫疾患の原因の解明に期待
研究成果のポイント
- 放射線などで切れてしまったDNAを修復するための初動対応の仕組みを発見
- RIF1によるDNA二本鎖切断の修復経路の制御に、脱リン酸化酵素PP1が関与
- 遺伝性の乳がん、卵巣がん、免疫疾患の原因解明や治療法の発展への貢献に期待
概要
大阪大学大学院理学研究科の磯部真也特任助教(常勤)、小布施力史教授らの研究グループは、損傷を受けたDNAを直ちに修復するための初動対応の仕組みを発見しました。
細胞が持つ生物の設計図であるDNAは、紫外線、放射線や化学物質、ウイルスなどによって絶えず損傷を受けており、その頻度は、1細胞あたり、1日に1万から100万箇所ともいわれています。中でも、DNAが完全に切れてしまう二本鎖切断(double-strand break; DSB)は、特に重篤なDNA損傷のひとつです。一方で、細胞は二本鎖切断を修復するしくみを備えており、非相同末端結合修復(non-homologous end-joining; NHEJ)と相同組換え修復(homologous recombination; HR)の2つの経路が知られています。NHEJでは、DNAの切断面をそのままつなぎ直すのに対し(図上・左)、HRでは切断箇所をわざと「削り込み」することによって一本鎖DNAを露出させ、それに似た配列を持つ別のDNAを鋳型にして修復を行います(図上・右)。
NHEJによる修復とHRによる修復は、直す二本鎖切断の状況や場所によって得意、不得意があり、実際の生物の細胞では2つの経路が巧みに使い分けられています。このどちらで修復するかは、DNAの「削り込み」を行うか(HR)、行わないか(NHEJ)によって決まります。二本鎖切断が起きた時に修復経路が適切に選択されないと、DNA配列の欠落、染色体の転座や重複などが生じて変異が蓄積し、細胞の老化やがん化のリスクが高まるとともに、様々な疾病を引き起こしてしまいます。
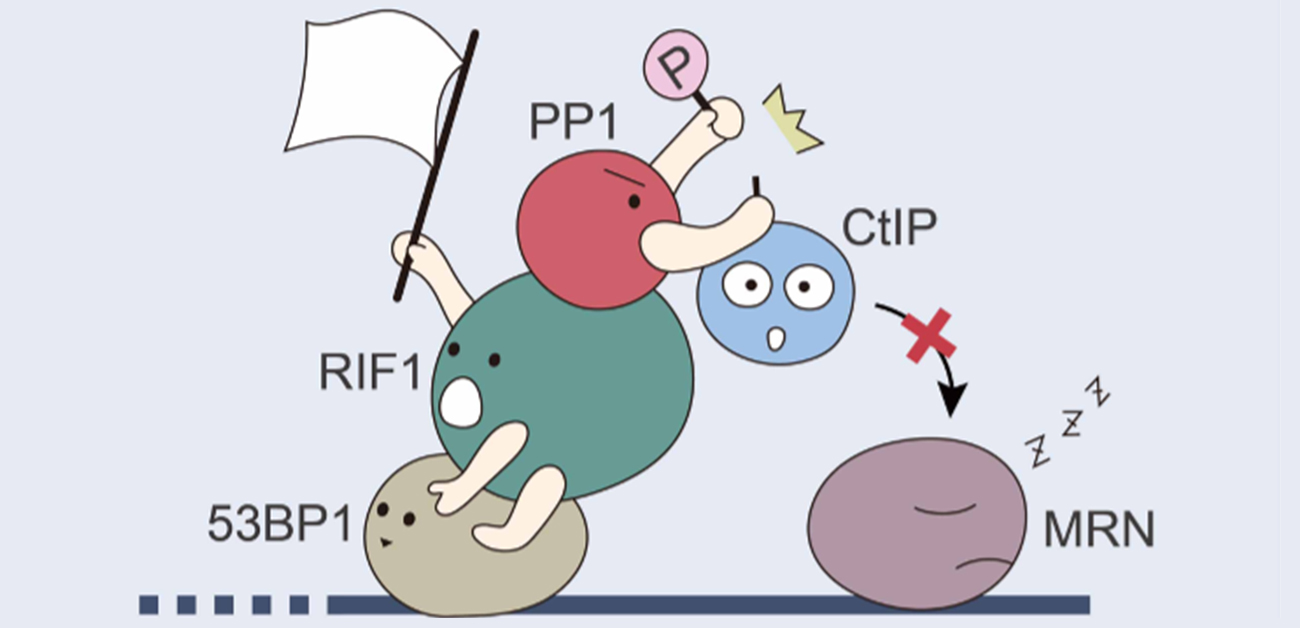
2018年に、RIF1というタンパク質(図:緑色の丸顔)がシールディン(Shieldin)タンパク質(図:お相撲さん)と結合して、削り込みの途中の一本鎖DNAに集まると削り込みの「伸展」が止まり、削られたDNAが埋め戻されてNHEJが選択されることが報告され、話題となりました。今回、私たちは、RIF1と結合してNHEJを引き起こす、シールディン以外のタンパク質、PP1(protein phosphatase 1)を発見しました。細胞の中でDNAの二本鎖切断が起こると、DNAの切断面にRIF1が集まってきます。私たちはこのRIF1にPP1(図:赤い丸顔)が結合すると、削り込みが「開始」しなくなる現象と、そのメカニズムを明らかにしました。
今回の発見から、細胞の中でDNAの二本鎖切断が起こると、DNAの切断面に集まったRIF1は、PP1を介して二本鎖切断の直後にDNA末端の削り込みの「開始」を防ぐことと、削り込みの途中でシールディンを介して削り込みの「伸展」を防ぐ、という2つの異なる方法により、HRに向かわせるDNA末端の削り込みを段階的に制御し、結果としてNHEJが選択されるという、二本鎖切断直後の初動対応の様子が見えてきました。
RIF1が関わるDNA修復の制御メカニズムは、ある種のがんや免疫機能に重要な役割を果たしていると考えられており、今回の研究成果はこれらの疾患の原因解明や治療に貢献できる可能性があります。
本研究成果は、英国のUniversity of Aberdeenとの国際共同研究であり、2021年7月14日(水) 午前0時(日本時間)に国際雑誌「Cell Reports」のオンライン版で公開されました。
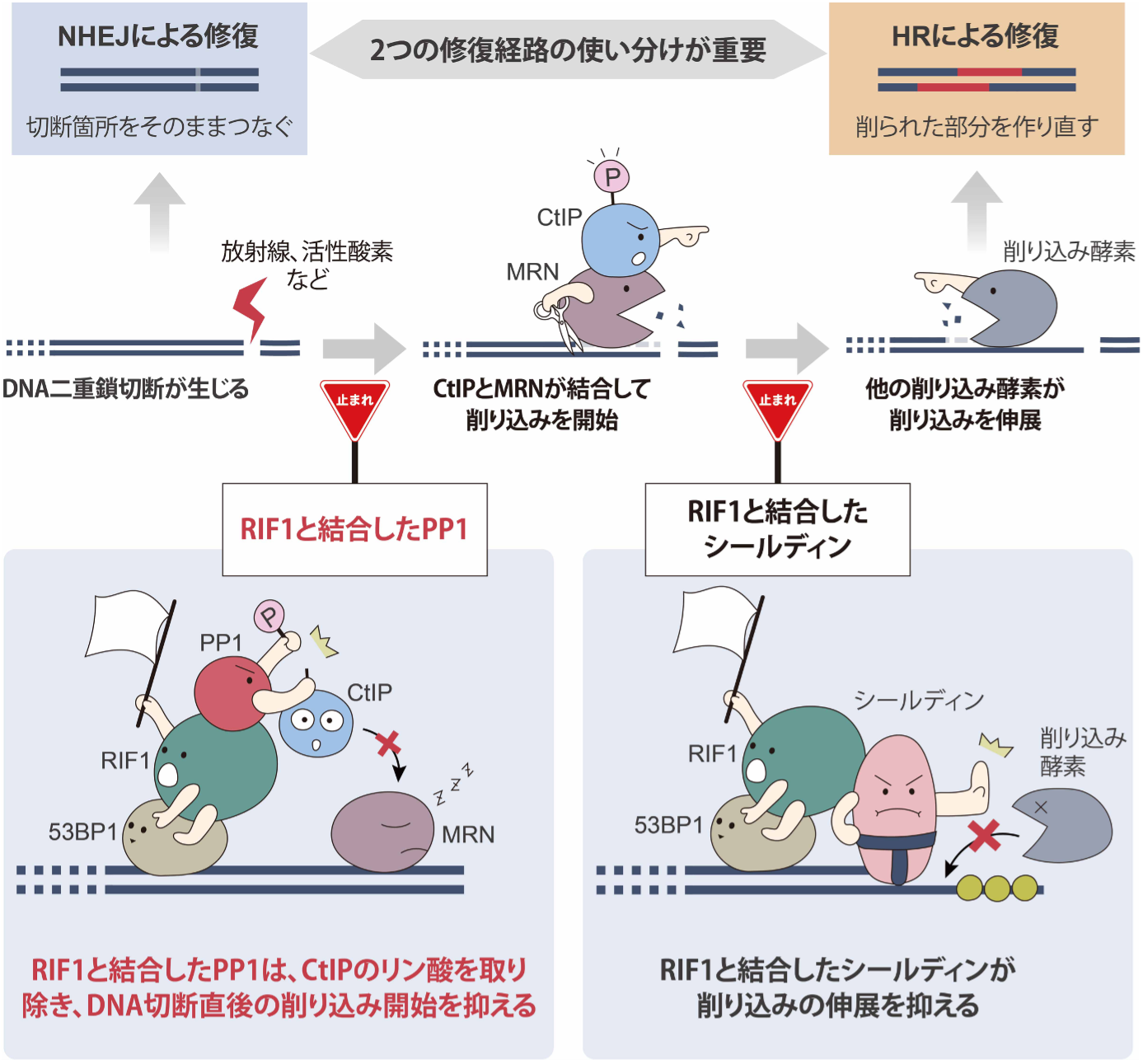
図 研究の概要
研究の背景
放射線などで生じたDSBを修復する仕組みとして、細胞はNHEJとHRの2つの経路を備えています。
これらのNHEJによる修復とHRによる修復は、直す二本鎖切断の状況や場所によって、得意、不得意があります。例えば、DNA複製の阻害で引き起こされる二本鎖切断は、NHEJでは正常に修復できないのでHRで修復する必要があります。一方、HRによる修復は鋳型にする相同染色体が必要なため、細胞分裂に先立ってDNA複製が行われた後にしか機能しません。また、ヒトのDNAには反復配列などの良く似た塩基配列が数多く存在しており、それらの間でHRが起こってしまうと、染色体転座や欠損という変異を引き起こすこともあります。そのため、実際の生物の細胞では2つの修復経路が巧みに使い分けられています。
二本鎖切断を2つの経路のどちらで修復するかは、DNAの「削り込み」を行うか(HR)、行わないか(NHEJ)によって決まります。放射線などにより二本鎖切断が生じると、切断面には、MRE11、RAD50、NBS1という3つのタンパク質から成り立つ、MRN と呼ばれる削り込みを行う酵素が集まってきます(図:紫色の丸顔)。そして、CtIPというタンパク質(図:青色の丸顔)が、リン酸化(リン酸の印が付加)することによって、MRNに結合します。すると、MRNの酵素は活性化されて、HRによる修復のために必要な一本鎖DNAを露出するための削り込みを開始します(図上・中)。
この仕組みに競合するようにはたらくのが、RIF1タンパク質です(図:緑の丸顔)。切断面にRIF1タンパク質が結合すると、削り込みが行われずNHEJによる修復が選択されます。
最近の報告から、切断面に存在するRIF1にシールディン(Shieldin)というタンパク質(図:お相撲さん)が結合すると、削り込み途中の一本鎖DNAに集まることで、削り込みの「伸展」が止まり、削り込み部分を埋め戻すことで、HRによる修復を抑制してNHEJによる修復が選択されることが明らかになりました。
一方、削り込みが開始する前にもNHEJによる修復が起こることも知られています。シールディンは削り込み開始後の一本鎖DNAに結合してはたらくので、私たちは、RIF1にはシールディンの他にも結合するタンパク質があって、MRNによる削り込みの開始を抑制しているのではないかと考えました。
本研究の内容
そこで本研究では、シールディン以外のRIF1に結合するタンパク質を質量分析により探索することにしました。その結果、PP1という脱リン酸化酵素(図:赤い丸顔)がRIF1に結合するタンパク質として見出されました。このPP1に着目して解析したところ、二本鎖切断が生じた直後のRIF1のはたらきにPP1が関与していることがわかりました。
リン酸は、様々なタンパク質に付加されたり(リン酸化)、外されたり(脱リン酸化)することで、そのタンパク質の活性や性質を変える修飾分子として知られています。PP1は、このリン酸をタンパク質から取り除く脱リン酸化酵素で、体内の様々な反応に関わっています。
実験により、PP1がRIF1に結合して働くと、CtIP(図:青い丸顔)に付加されているリン酸(図:Pと書かれたピンクの玉)がはずされ、MRNに結合して削り込みの反応を活性化するという本来の働きができなくなります(図下・左)。すなわち、RIF1に結合したPP1はMRNによるDNAの削り込みの開始を抑制していることがわかりました。
今回の私たちの発見から、細胞の中でDNAの二本鎖切断が起こると、DNAの切断面に集まったRIF1は、PP1を介して二本鎖切断直後にDNA末端の削り込みの「開始」を防ぐことと、削り込みの途中で、シールディンを介して削り込みの「伸展」を防ぐ、という2つの異なる方法によりHRに向かわせるDNA末端の削り込みを段階的に制御しているという、二本鎖切断直後の初動対応の様子が見えてきました。
本研究成果が社会に与える影響(本研究成果の意義)
DNA損傷修復に関わる遺伝子の変異はさまざまな疾患の原因となることが知られています。例えば、RIF1は、乳がん、卵巣がんの原因遺伝子であるBRCA1と深い関わりがあります。BRCA1はHRによる修復を促進する遺伝子で、この遺伝子に変異があるとHRによる修復機能が低下し、それに伴い、乳がんを発症する生涯リスクが80%になるという報告もあります。オラパリブ (Olaparib)という抗がん剤は、このHRによる修復機能の低下を逆手に取り、がん細胞を殺す薬です。しかしながら、投薬を続けるとオラパリブの効かない細胞 (抗がん剤耐性細胞)が現れてくることが知られており、問題になっています。RIF1の機能に問題があると、NHEJによる修復への誘導が起こらないため、BRCA1がない状態でも異常なHR経路が発動され、抗がん剤耐性細胞になることが実験的に証明されています。今回私たちが発見したRIF1と結合しているPP1の働きは、シールディンとともにRIF1のDNA損傷修復における機能そのものであるため、抗がん剤耐性細胞が出現する仕組みや、解決への糸口になる可能性があります。
また、RIF1の機能不全が免疫疾患を引き起こすことも知られています。免疫反応に重要な抗体タンパク質の産生にはNHEJのメカニズムが利用されており、NHEJの効率が下がると体内の抗体の産生量が減少するためです。抗体産生にはRIF1に結合しているシールディンが関わる反応と、RIF1が関与するにもかかわらずシールディンが関与しない反応があることが報告されています。ここでもRIF1に結合しているPP1がはたらいている可能性は十分考えられます。
今回の我々の発見は基礎的な知見ですが、将来的にこれらの疾患の原因解明や治療に貢献することが期待できるのではないかと考えています。
特記事項
本研究成果は、2021年7月14日(水)午前0時(日本時間)に国際科学誌「Cell Reports」(オンライン)に掲載されました。
タイトル:“Protein Phosphatase 1 acts as a RIF1 effector to suppress DSB resection prior to Shieldin action”
著者名:Shin-Ya Isobe, Shin-ichiro Hiraga, Koji Nagao, Hiroyuki Sasanuma, Anne D Donaldson, and Chikashi Obuse
なお、本研究は、英国のUniversity of Aberdeenとの国際共同研究であり、JSPS科研費 JP19H03156, JP18H04713, JP18H05532, JP25116004, JP18H04900, JP19H04267, 三菱財団、Cancer Research UK awards C1445/A19059, DRCPGM/100013の助成を受けたものです。
参考URL
小布施 力史教授 研究者総覧URL
http://osku.jp/k0658
用語説明
- DNA二本鎖切断
本鎖のDNAが切断されて生じる損傷のことで、細胞にとって最も脅威なDNA損傷の1つと考えられている。放射線による被曝や細胞がエネルギーを産生する時に生じる活性酸素などにより生じる。普通の生活でもDNA損傷の数は細胞あたり一日数万から数十万個になると言われており、 そのうち100箇所程度はDNA二本鎖切断と考えられている。DNA二本鎖切断が完全に修復されないと、細胞は正常に増殖することができず、がん化や細胞死を引き起こすことが知られている。
- 非相同末端結合修復
DNA二本鎖切断の修復経路の1つで、近くのDNA末端同士を結合して修復する。放射線などにより生じる損傷に対して素早く反応することができるが、切断部位のDNA情報が一部欠損してしまう場合が多い。
- 相同組換え修復
DNA二本鎖切断の修復経路の1つで、損傷がおきた部分と同一の正常な配列を探し出して、鋳型にして組換え機構により修復する。多くの場合、DNA情報の欠損が発生しないが、鋳型となる同一のDNA配列がない時は働けない。また、非常に似通った配列を間違えて鋳型としてしまい、DNA情報の変異を引き起こしてしまう欠点がある。
- オラパリブ (Olaparib)
2014年、アメリカ食品医療品局 (FDA)により承認された抗がん剤で、日本においても2018年にリムパーザという名前で承認されている。BRCA1、BRCA2に変異をもつ卵巣がん、乳がん、前立腺がん、膵臓がん等の治療に用いられている。BRCA1やBRCA2などの変異により相同組換え修復が正常に行われない細胞では、オラパリブにより生じた複雑なDNA二本鎖切断を直すことができず、細胞死を誘導すると考えられている。
