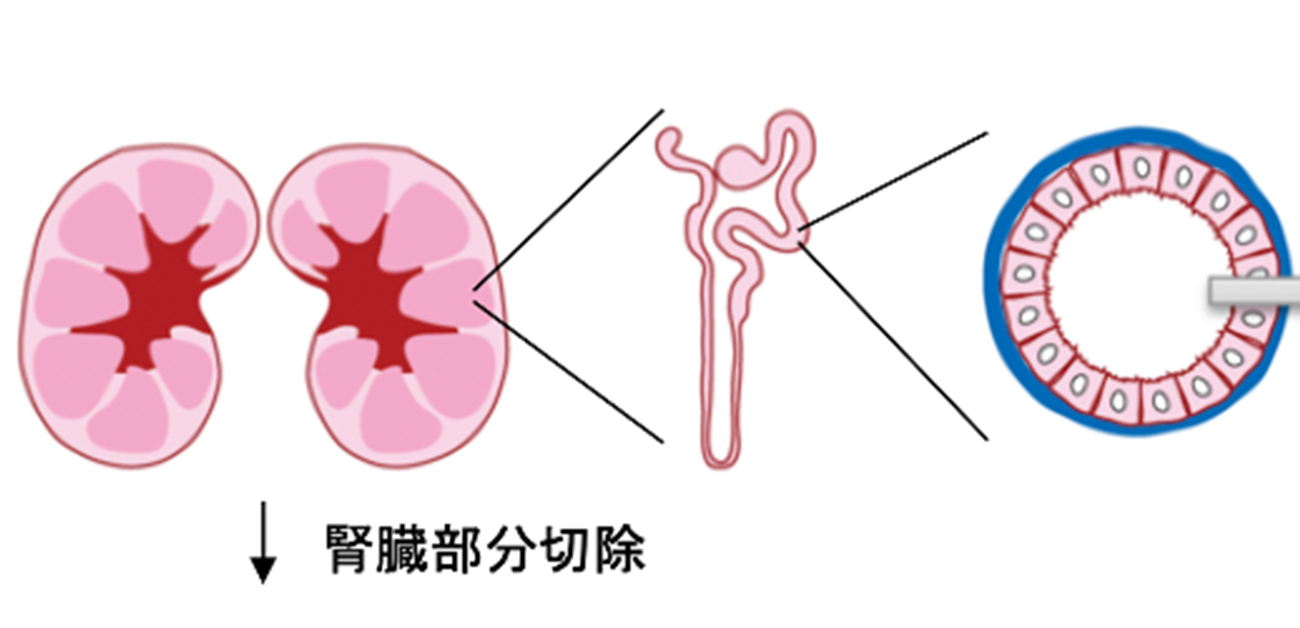
腎臓切除後の代償性肥大の仕組みを解明
細胞外環境の再整備メカニズムの発見
研究成果のポイント
概要
大阪大学微生物病研究所の梶原健太郎助教、岡田雅人教授らの研究グループは、腎臓切除後に残った腎臓が代償的に肥大化する新たな仕組みを世界で初めて明らかにしました。腎臓の一部を切除すると、失われた機能を補うために残った腎臓が大きくなりますが(代償性肥大)、そのメカニズムは不明でした。本研究グループは、腎臓切除後、肝細胞増殖因子(HGF)が一時的に増え、細胞の肥大化と増殖、細胞外環境の再整備が起こるメカニズムを明らかにしました(図1)。
これまで腎臓が肥大化する現象は、mTOR栄養シグナルによる細胞の肥大化と増殖が重要であると考えられており、細胞をとりまく細胞外環境と肥大化の関連性については解明されていませんでした。今回、本研究グループは、腎臓尿細管由来の細胞とHGFを使った実験により、腎臓の肥大化には従来から知られていた細胞の肥大化と増殖だけでなく、細胞外マトリックスの再編成による細胞外環境の再整備も重要であることを解明しました。これにより、腎臓の部分切除や障害を負った後の効率的な機能回復・亢進など医療への応用が期待されます。
本研究成果は、米国科学誌「Life Science Alliance」に、2月11日(木)23時(日本時間)に公開されました。
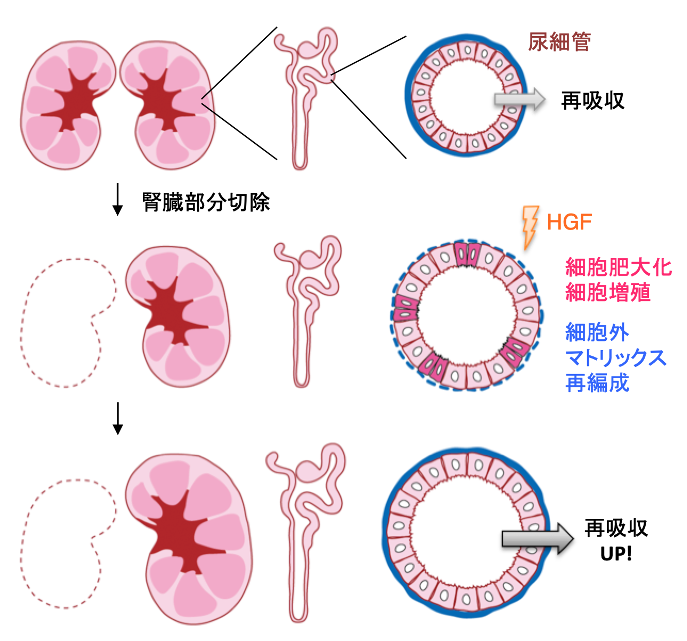
図1 HGFによる腎臓の代償性肥大のメカニズム
研究の背景
これまで、病気の治療のために腎臓の一部を切除すると、失われた機能を補うために残った腎臓が大きくなることが知られていました。このときmTOR栄養シグナルの活性化による細胞の肥大化と増殖の亢進が重要であることが知られています。しかし、それだけでは肥大化のメカニズムを説明できず、その他のシグナル経路の関与も考えられてきましたが、謎のままでした。
HGFはMetと呼ばれる受容体に結合し、機能することが知られています。本研究グループは、腎臓の部分切除後にHGFとその受容体(Met)が一過的に増えることに注目をして、研究を開始しました。まず肥大化が起こる尿細管に注目して、尿細管由来の細胞を三次元培養してHGFを処理することで、尿細管肥大化を試験管内で再現する実験モデルを構築しました。このモデルを利用して、顕微鏡を用いたイメージング解析を行った結果、細胞の肥大化と増殖に加えて、細胞が形態変化することを見いだしました。この変化は、これまで重要とされてきたmTOR栄養シグナルの阻害剤では完全に抑制されなかったことから、別のシグナル伝達の関与が考えられました。さらなる解析の結果、リン酸化を担うタンパク質Srcとその局在を制御するタンパク質CDCP1の関与を見出しました(図2)。さらに、このCDCP1はMetと結合して、SrcからSTAT3へのリン酸化を仲介していることを明らかにしました。STAT3がリン酸化されて活性化すると、細胞増殖を促進するだけでなく、細胞外マトリックスの分解酵素の発現を亢進させて細胞外環境を再編成していることが分かりました。一方、CDCP1をノックアウトした細胞では一連の現象が減弱していたことから、CDCP1はHGF-Metシグナル伝達を仲介して細胞外マトリックスの分解酵素の発現を上昇させているタンパク質であることを明らかにしました。
そこでCDCP1ノックアウトマウスの腎臓の代償性肥大を評価した結果、野生型のマウスと比較して肥大化が弱いことを確認しました。さらに詳細な解析を行った結果、MetとSTAT3シグナルの活性化が減弱しており、細胞の肥大化と増殖、さらに細胞外マトリックスの再編成がうまく進行していないことが分かりました。
これらの結果から、これまで腎臓の代償性肥大にはmTOR栄養シグナルによる細胞の肥大化と増殖が重要であるとされてきましたが、STAT3シグナルを介した細胞外環境の整備も重要であることを解明しました。
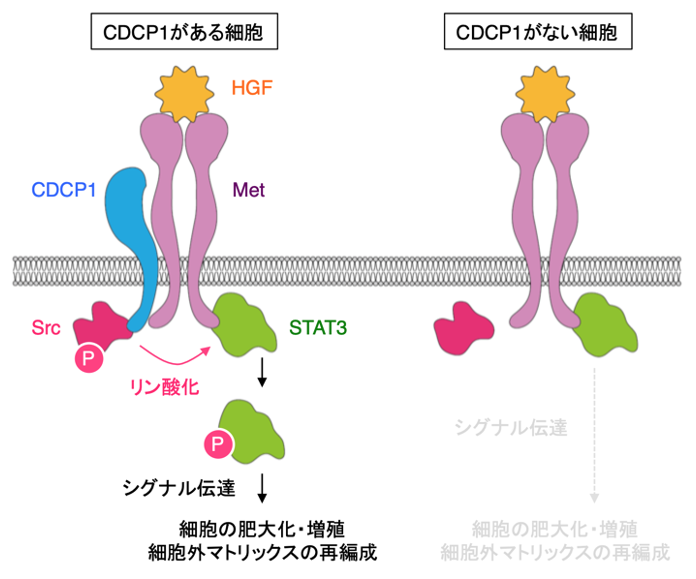
図2 CDCP1によるHGF-Metシグナル伝達の制御
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、今回発見されたメカニズムをターゲットにすることで、腎臓が部分切除や障害を負った後の効率的な機能回復・亢進など医療への応用が期待されます。また、HGF-Metシグナルは様々な生命現象に関与しています。今回明らかになったCDCP1によるMetの制御は、個体発生や組織の再生など生命現象の調節メカニズムとして機能していることが推測されることから、今後の研究の進展が望まれます。
特記事項
本研究成果は、2021年2月11日(木)23時(日本時間)に米国科学誌「Life Science Alliance」(オンライン)に掲載されます。
タイトル:“CDCP1 promotes compensatory renal growth by integrating Src and Met signaling”
著者名:Kentaro Kajiwara, Shotaro Yamano, Kazuhiro Aoki, Daisuke Okuzaki, Kunio Matsumoto and Masato Okada
なお、本研究は、科学研究費補助金若手研究(B)(26830071)、基盤研究(C)(19K07639)、基盤研究(B)(19H03504)、新学術領域研究(19H04962)、同(16H01447)、武田科学振興財団医学系研究奨励、金沢大学がん進展制御研究所の支援を受け、日本バイオアッセイ研究センター、基礎生物学研究所、金沢大学の共同研究チームによって実施されました。
参考URL
微生物病研究所 発癌制御研究分野 ウェブサイト
http://www.biken.osaka-u.ac.jp/biken/oncogene/index.htm
用語説明
- 代償性肥大
腎臓は血中の老廃物や余分な水分・塩分を取り除いて、尿を生成する臓器であり、健康維持に必須である。この腎臓の機能が失われると、状況によっては透析療法や腎移植が必要になる。通常、ふたつの腎臓をもつが、生まれつき片方しかない場合や手術で一部を切除した場合には、残された腎臓が機能を補うために大きくなる(肥大化)。この際、血液をろ過する糸球体や尿が通る尿細管が大きくなることが知られている。
- 尿細管細胞
腎臓では、血液が糸球体という構造物に流入して濾されて「原尿」とよばれる尿のおおもとが作られる。原尿は「尿細管」に送られ、この管を通る過程で生命維持に必要な水分や電解質、ブドウ糖などの成分が再吸収されて尿ができる。この尿細管を構成するのが尿細管細胞で、原尿からの必要な物質の再吸収など物質のやり取りを担っている。
- 肝細胞増殖因子(HGF)
細胞が産生する増殖因子のひとつで、肝臓や腎臓などで作られる。HGFが細胞の表面にある受容体(Met)に結合すると、細胞内のシグナル伝達が活性化する。その結果、細胞の増殖や運動が促され、組織の修復や再生が起こる。中村 敏一 大阪大学名誉教授らのグループによって世界で初めて同定された。
- mTOR栄養シグナル
アミノ酸や増殖因子、エネルギー状態など細胞内外の情報を感知して、細胞のサイズや増殖を調節するシグナル。アミノ酸や増殖因子が豊富に存在すると、mTORシグナルが活性化してタンパク質や脂質の合成が促進され、細胞が肥大化・増殖する。
- 細胞外マトリックス
細胞の周囲に存在して、細胞や組織の構造を支える役割を果たしている。その合成と分解によって、細胞や組織の機能の一部が制御されている。主な成分はコラーゲンである。
- Src
世界で最初に見つかったがん遺伝子。がんだけでなく、細胞増殖や生体の形態維持など、生命において極めて重要な役割を果たしている。今回のように、HGFなどの細胞外からの刺激を細胞内に伝える役割を担っており、個体発生や細胞増殖など様々な生体反応に関わっている。
- STAT3
細胞内外の刺激(リン酸化)によって活性化して、核内で遺伝子の転写を制御する因子。細胞の増殖や運動、細胞外マトリックスの再編成などに関与している。免疫やがんなどにも関与している。岸本 忠三 大阪大学免疫学フロンティア研究センター特任教授、審良 静男 大阪大学免疫学フロンティア研究センター特任教授(常勤)らのグループによってその研究の端緒が開かれた。
