がん細胞の運命決定因子を同定
浸潤か排除か、それが問題だ
研究成果のポイント
- がん化した細胞がさらに浸潤するか、周囲の細胞によって排除されるか、運命を決定する因子を明らかにした。
- 細胞のがん化に重要なタンパク質Srcが脂質ラフトに集積することで浸潤が進むことを明らかにした。その反対に、Srcが脂質ラフトに集まらなければ、がん化細胞は排除される。
- Srcの集積を担っているタンパク質としてCDCP1を同定した。CDCP1が過剰に存在すると細胞は浸潤に至るが、このタンパク質の機能を阻害することで細胞は排除される。
- CDCP1は肺がんや膵がんのがん化初期において発現量が増加しており、がん化初期の創薬ターゲットになりうる。
概要
大阪大学 微生物病研究所の梶原健太郎助教、岡田雅人教授(感染症総合教育研究拠点兼任)らの研究グループは、がん化した細胞が浸潤するか、排除されるかの運命を決める因子を初めて明らかにしました。がんは超初期段階で周囲の細胞により排除されることが最近明らかになってきましたが、初期段階で排除されずに増殖、悪性化するがん細胞も存在します。排除されるか、悪性化するか、このがん細胞の運命決定メカニズムはこれまでほとんど解っていませんでした。この運命決定機構を明らかにするため梶原助教らの研究グループは、正常細胞にがん遺伝子産物Srcを発現させてがん化を誘導し、正常細胞集団内での振る舞いを解析しました。その結果、Srcが脂質ラフトに集積する場合には、その細胞は浸潤するが、脂質ラフト外に集積する場合には、排除されることを明らかにしました(図)。さらに、Srcの集積を担うタンパク質CDCP1を同定し、その分子メカニズムを明らかにしました。このCDCP1の機能を阻害することで、がん細胞は排除されることを見出しました。CDCP1は肺がんや膵がんのがん化初期において既に発現量が増加していることから、がん化初期の創薬ターゲットになりうる可能性が示されました。本研究成果は、米国科学誌「Current Biology」オンライン版に7月9日(土)0時(日本時間)に公開されました。
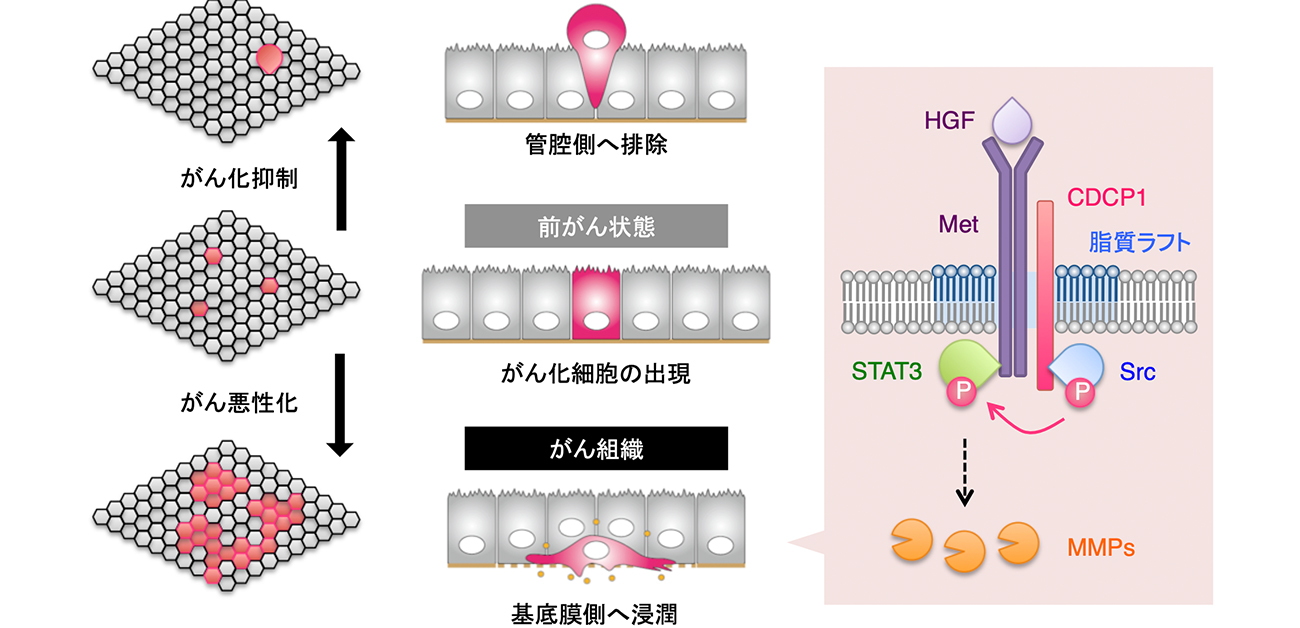
図. 研究成果の概略図
遺伝子の変異により、正常細胞の一部ががん化する。がん化した細胞は周囲の正常細胞により排除されるか、浸潤する。この運命がどのように決まるか不明であった。本研究から、SrcがCDCP1によって脂質ラフトに集積すると、Metとの結合を介してSTAT3-MMP 経路の活性化が起こり、がん化細胞は排除を凌駕、さらに浸潤に至ることが明らかになった。
研究の背景
がんははじめ1つのがん細胞から発生すると考えられていますが、このがん化の超初期段階ではがん細胞は周囲の正常細胞によって積極的に排除されることが近年明らかになってきました。この現象は「細胞競合」と呼ばれ、がん化を防ぐために生体に備わっている防御システムのひとつと考えられています。しかし、がん細胞は次第に排除システムに打ち克ち、大きながん組織になり、やがて一部のがん細胞は周囲の組織へ侵入(浸潤)します。このがん細胞の運命を変える要因は不明でした。
研究の内容
研究グループはまず、生体内のがん化超初期を模倣する実験系を試験管内に構築しました。具体的には、正常細胞に改変を加えて、がん遺伝子産物Srcの発現による細胞がん化を誘導できるようにして、正常細胞集団内での振る舞いを観察しました。
その結果、一部のがん化細胞は細胞競合によって排除されるものの、次第に細胞層から周辺の組織に浸潤するようになりました。浸潤したがん化細胞は、排除システムのトリガーとなるタンパク質を一部発現しているものの不完全であり、周囲の正常細胞では細胞競合関連タンパク質の発現増加は認められませんでした。これらの結果から、一部のがん化細胞は排除システムを回避して、浸潤に至る可能性が見出されました。
そこで、がん化細胞の排除と浸潤の運命を決める要因を解析しました。異なる運命に至る2つの細胞を比較したところ、Srcの細胞膜での集積場所の違いが見出されました。Srcが脂質ラフト内に集積する場合は浸潤に至り、そうでない場合は排除されることが明らかになりました。
次に、Srcが脂質ラフトに集積する場合の細胞内の変化を解析しました。その結果、Srcが脂質ラフトに集積すると、STAT3のシグナル伝達が活性化されていることが見出されました。さらに、STAT3の活性化を阻害することで、がん化細胞の浸潤を抑制できることが明らかになりました。
次に、Srcが脂質ラフトに集積するメカニズムを解析しました。運命が異なる2つの細胞の脂質ラフトを解析したところ、存在するタンパク質がわずかに異なることが明らかになり、そのうちSrcとの関連が明らかになっているCDCP1に注目しました(https://resou.osaka-u.ac.jp/ja/research/2021/20210211_2)。
CDCP1を過剰に発現すると、Srcが脂質ラフト内に集積し、細胞は次第に浸潤しました。これに対して、CDCP1が脂質ラフトに局在できないように変異を導入すると、Srcは脂質ラフト外に集積し、細胞は排除されました。以上の結果から、CDCP1はSrcの脂質ラフトへの集積を担うタンパク質のひとつであること、CDCP1の機能を阻害することでがん化細胞の運命転換が起こることが明らかになりました。
CDCP1は肺がんや膵がんにおいて、がん化初期に発現量が増加すること、さらに、がん細胞の浸潤にも重要であることがわかりました。すなわち、CDCP1はがん化の初期から浸潤に至るまでの様々な過程に関与する因子であることが明らかになりました。このことから、CDCP1は悪性化したがんだけでなく、がん化初期の創薬ターゲットになりうる可能性が示されました。
本研究成果が社会に与える影響(本研究成果の意義)
日本では2人にひとりががんになり、5人にひとりががんで亡くなっています。現在、様々な分子標的薬やがん免疫療法などが開発されており、がん患者の生存率は改善しています。今後、さらなる改善を目指すには、がん細胞を効率的に排除する新たなアプローチが必要です。本研究では、がん細胞が正常細胞による排除を回避して浸潤する戦術を明らかにしました。さらにがん細胞を排除するための標的を見いだしました。このがん細胞の運命転換を誘導することで、正常細胞を利用してがん細胞を効率的に排除することが可能になるかもしれません。
特記事項
本研究成果は、米国科学誌「Current Biology」オンライン版に7月9日(土)0時(日本時間)に公開されます。
タイトル:“Src activation in lipid rafts confers epithelial cells with invasive potential to escape from apical extrusion during cell competition”
著者名:Kentaro Kajiwara, Ping-Kuan Chen, Yuichi Abe, Satoru Okuda, Shunsuke Kon, Jun Adachi, Takeshi Tomonaga, Yasuyuki Fujita, Masato Okada
なお、本研究は、日本学術振興会 科学研究費補助金 基盤研究(C)(19K07639)および新学術領域研究(26114001)の支援を受け、大阪大学、京都大学、東京理科大学、愛知県がんセンター研究所、医薬基盤・健康・栄養研究所、金沢大学の共同研究チームによって実施されました。
参考URL
微生物病研究所 発癌制御制御分野
http://www.biken.osaka-u.ac.jp/biken/oncogene
用語説明
- Src
細胞内の情報伝達のひとつリン酸化を担うタンパク質。様々な刺激によりリン酸化(活性化)され、さらに基質タンパク質をリン酸化することで、細胞内に様々な情報をリレーのように受け渡している。この情報伝達は生物の正常な発生や組織修復などに重要であるが、過剰に活性化するとがん化や悪性化が進行する。
- 脂質ラフト
細胞膜上に存在する情報伝達の中継ポイント。コレステロールやスフィンゴ脂質などが集まってできている特異的な膜領域。様々な情報伝達を担うタンパク質も集まっていることから、細胞内外の情報伝達の中継地点の役割を果たしていると考えられている。ラフトは筏(いかだ)のこと。
- CDCP1
脂質ラフトに存在するSrcリクルートタンパク質のひとつ。様々な情報伝達を担うタンパク質と結合することで、多彩な情報伝達を制御していると考えられている。がん細胞だけでなく、正常細胞にも存在しており、臓器の機能維持などに関与していることが明らかにされている。(https://resou.osaka-u.ac.jp/ja/research/2021/20210211_2)
- 細胞競合
正常細胞と異常細胞の間の適者生存システム。直接的な接触を介した細胞間コミュニケーションにより、適応度の高い細胞が残り、低い細胞が排除される。その際、正常細胞が異常細胞を積極的に排除することが明らかにされている。この現象は正常細胞とがん細胞の場合だけでなく、発生過程などでも同様に確認されている。
- STAT3
細胞内外の刺激によって活性化(リン酸化)して、核内で遺伝子の転写を制御する因子。細胞の増殖や運動などに関与している。免疫などにも関与している。岸本 忠三 大阪大学免疫学フロンティア研究センター特任教授、審良 静男 大阪大学免疫学フロンティア研究センター特任教授(常勤)らのグループによってその研究の端緒が開かれた。