神経難病ポリグルタミン病の新しい治療薬候補を発見
L-アルギニンのタンパク質構造安定化作用による凝集抑制効果
研究成果のポイント
・アミノ酸の一つであるL-アルギニンが神経難病であるポリグルタミン病の治療薬候補になることを発見しました。
・L-アルギニンがポリグルタミンタンパク質の構造を安定化して凝集を抑制し、ポリグルタミン病モデル動物の運動症状や神経変性を改善することを見出しました。
・家族性脊髄小脳変性症を含むポリグルタミン病の新たな治療法開発へ向けて、医師主導治験を実施する予定です。
概要
大阪大学大学院医学系研究科 永井義隆寄附講座教授(神経難病認知症探索治療学)の研究グループは、新潟大学脳研究所脳神経内科学兼脳研究所所長 小野寺理教授、国立精神・神経医療研究センター(NCNP)神経研究所 和田圭司所長(現顧問)、同疾病研究第四部 皆川栄子研究員、ポピエルヘレナ明子研究員(現・東京医科大学)との共同研究で、L-アルギニンがポリグルタミン病 の有力な治療薬候補化合物であることを見出しました。
ポリグルタミン病では、ポリグルタミン鎖の異常伸長により変異タンパク質の構造が不安定になって凝集しやすくなり、その結果、脳や脊髄内の神経細胞内に封入体として蓄積し、最終的に神経細胞死を引き起こします。これまでに、異常伸長ポリグルタミンタンパク質の凝集抑制作用を持つ化合物がいくつか同定されてきたものの、人体への安全性が低い、脳内に取り込まれにくい等の理由で、治療薬としての臨床応用が困難でした。
今回、研究グループは、化学シャペロン と呼ばれる一連の化合物の中から、アミノ酸の一種であるL-アルギニンがポリグルタミンタンパク質の立体構造を安定化させて凝集を抑制することを見出しました (図1) 。さらに、2種類のマウスモデルを含む様々なポリグルタミン病モデル動物にL-アルギニンを経口投与したところ、モデル動物の運動症状や脳病理所見を改善させることを明らかにしました。L-アルギニンは本邦において医薬品として既に承認されており、先天性尿素サイクル異常症やミトコンドリア脳筋症の患者さんへの投与実績から人体への安全性、高い脳移行性が確認されています。したがって、L-アルギニンはポリグルタミン病に対する分子標的治療薬として、すみやかに臨床応用されることが期待されます。本研究成果は、英国科学誌「Brain」に、5月22日(金)に公開されました。
なお研究グループでは、現在、ポリグルタミン病の中でも本邦において患者数の多い脊髄小脳失調症6型を対象としてL-アルギニンの安全性と有効性を調べるための医師主導治験(第II相試験)を計画しています。
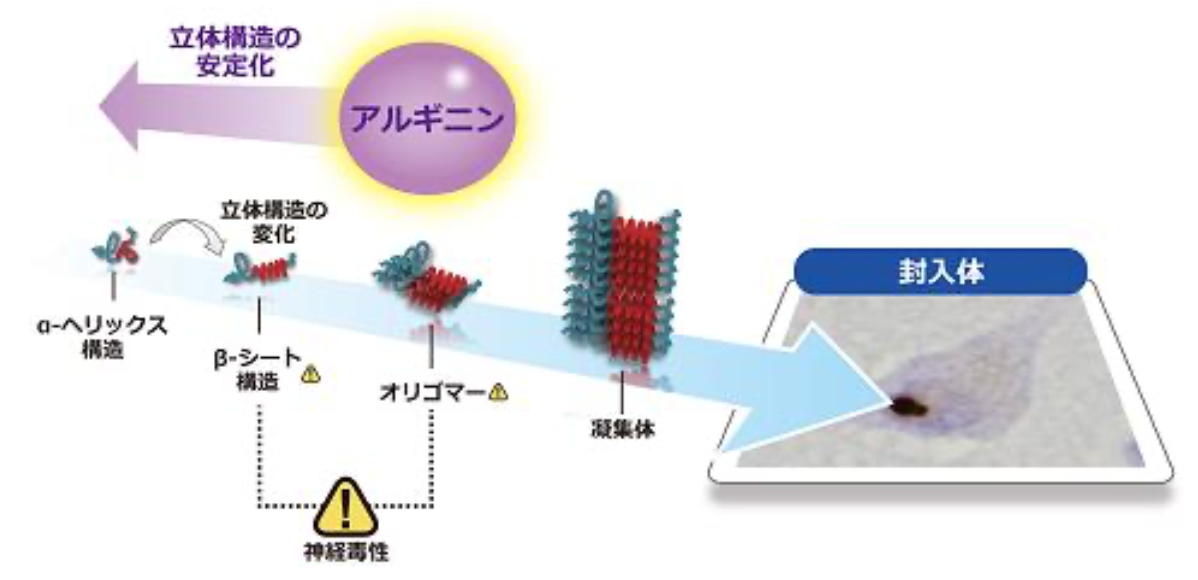
図1 ポリグルタミン病におけるポリグルタミンタンパク質の構造変化とアルギニンのタンパク質構造化安定作用
研究の背景
脊髄小脳変性症 は、小脳や脊髄などの神経細胞が変性・脱落して、歩行時のふらつき、ろれつが回らないなどの様々な神経症状があらわれ、徐々に進行する疾患です。わが国の患者数は約3万人で、そのうち家族性脊髄小脳変性症の患者数は約1万人と推定されています。家族性脊髄小脳変性症のうち、患者数の約2/3を占める7つのタイプ(脊髄小脳失調症1、2、3、6、7、17型、歯状核赤核淡蒼球ルイ体萎縮症)で、原因遺伝子内のグルタミンをコードするCAG配列の繰り返し回数の異常伸長(40回以上)という共通の遺伝子変異が見つかっており、同様の遺伝子変異を持つハンチントン病、球脊髄性筋萎縮症とあわせて、ポリグルタミン病と総称されています。
ポリグルタミン病では、変異遺伝子から健常人よりも長いグルタミン鎖を持つポリグルタミンタンパク質が産生されます。このポリグルタミン鎖の異常伸長によりポリグルタミンタンパク質(以下、異常伸長ポリグルタミンタンパク質)の立体構造が不安定化し、βシート構造 を持った単量体やオリゴマーと呼ばれる重合体が形成されやすくなります。その結果、これらの異常伸長ポリグルタミンタンパク質は難溶性の凝集体を形成して、神経細胞の中に封入体と呼ばれる沈着物として蓄積します。最近では凝集体や封入体よりもβシート単量体やオリゴマーの方が強い神経毒性を持つと考えられています (図1) 。そして、最終的に神経細胞の機能が低下し、神経細胞死を引き起こすと考えられています。
これまで異常伸長ポリグルタミンタンパク質の凝集を標的としたポリグルタミン病の治療法開発に関する研究が進められ、本研究グループの成果も含めていくつかの凝集抑制作用を持つ治療薬候補化合物が同定されてきました。しかしながら、いずれの化合物も人体への安全性が低い、脳内に取り込まれにくい、体内ですみやかに分解されてしまう等の理由で臨床応用が困難とされ、ポリグルタミン病に対しては有効な治療法が乏しい状況にありました。
本研究の成果
今回、研究グループは、タンパク質の立体構造を安定化させる化学シャペロンと呼ばれる一連の化合物のうちL-アルギニンが、試験管内で異常伸長ポリグルタミンタンパク質の正常構造であるαヘリックス構造 から神経毒性の高いβシート構造への立体構造変化を抑制し、凝集体の形成を抑制することを見出しました。
そこで、様々なポリグルタミン病モデル動物にL-アルギニンを投与し、治療効果を検証しました。まずポリグルタミン病の1つである脊髄小脳失調症3型(SCA3)のモデルショウジョウバエにL-アルギニンを投与したところ、複眼変性が抑制されることを見出しました (図2) 。次に、ポリグルタミン病の1つである脊髄小脳失調症1型(SCA1)のモデルマウスにL-アルギニンを経口投与したところ、運動症状が改善されることを見出しました。この時のSCA1モデルマウスの脳内を調べてみると、異常ポリグルタミンタンパク質の封入体が減少し、小脳神経細胞の変性が抑制されることを見出しました (図3) 。またSCA1モデルマウスが運動症状を発症してからL-アルギニンを投与した場合にも、その後の運動症状が緩和されることが分かりました。さらに、別のポリグルタミン病である球脊髄性筋萎縮症のモデルマウスにおいても、L-アルギニンの経口投与によって運動症状が改善されることを見出しました。

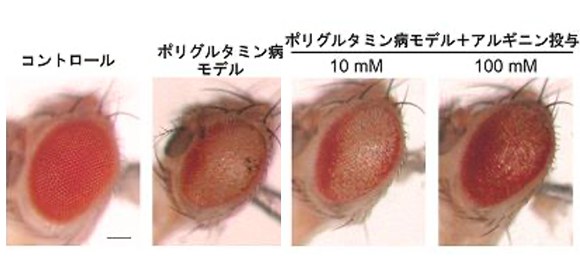
図2 アルギニンはSCA3モデルショウジョウバエの複眼変性を抑制する
SCA3モデルショウジョウバエでは、異常伸長ポリグルタミンタンパク質により複眼組織の神経細胞が徐々に変性・脱落する(右上)。このモデルにアルギニンを投与すると、複眼組織の変性が抑制された(下段)。

図3 アルギニンはSCA1マウスの小脳神経細胞の変性を抑制する
SCA1モデルマウスでは、小脳の神経細胞の一種であるプルキンエ細胞の変性がみられる(左、*印の部位)。このモデルにアルギニンを投与すると、プルキンエ細胞の変性が抑制される傾向がみられた(右)。
本研究成果が社会に与える影響(本研究成果の意義)
L-アルギニンは生体内に存在するアミノ酸の一種であり、血液脳関門 を透過して脳内に取り込まれることが知られており、今回の研究でも、L-アルギニンがマウスの脳内に移行することを確認しています。またL-アルギニンは本邦において医薬品として既に承認されており、先天性尿素サイクル異常症やミトコンドリア脳筋症の患者さんへの投与実績から人体への安全性が確認されています。したがって、L-アルギニンはポリグルタミンタンパク質の構造安定化作用を通じてポリグルタミン病におけるタンパク質の凝集を抑制する分子標的治療薬として、すみやかな臨床応用が期待されます。本研究成果により、これまで治療法の乏しかったポリグルタミン病に対して、L-アルギニンが、疾患の進行を緩和しうる治療薬として有効であることが期待されます。今後、本研究グループでは、本邦において患者数の多いポリグルタミン病である脊髄小脳失調症6型を対象に、L-アルギニンの安全性と有効性を調べるための医師主導治験(第II相試験)を計画しています。この医師主導治験は、新潟大学脳研究所・小野寺理教授を中心として、新潟大学・大阪大学・国立精神・神経医療研究センター・東京医科歯科大学での実施を予定しています。
特記事項
本研究成果は、2020年5月22日(金)に英国科学誌「Brain」(オンライン)に掲載されました。
【タイトル】“Arginine is a disease modifier for polyQ disease models that stabilizes polyQ protein conformation”
【著者名】Eiko N. Minakawa 1* , Helena Akiko Popiel 1,4* , Masayoshi Tada 5 , Toshiaki Takahashi 5 , Hiroshi Yamane 1 , Yuji Saitoh 1 , Yasuo Takahashi 6 , Daisaku Ozawa 2 , Akiko Takeda 2 , Toshihide Takeuchi 1,2 , Yuma Okamoto 1,4 , Kazuhiro Yamamoto 1 , Mari Suzuki 1,2 , Hiromi Fujita 1 , Chiyomi Ito 4 , Hiroko Yagihara 1 , Yuko Saito 7 , Kei Watase 8 , Hiroaki Adachi 9 , Masahisa Katsuno 9 , Hideki Mochizuki 3 , Kentaro Shiraki 10 , Gen Sobue 9 , Tatsushi Toda 4 , Keiji Wada 1 , Osamu Onodera 5 , Yoshitaka Nagai 1,2,3,4 (*: 筆頭共著者)
【所属】
1.国立精神・神経医療研究センター 神経研究所 疾病研究第四部
2.大阪大学大学院医学系研究科 神経難病認知症探索治療学寄附講座
3.大阪大学大学院医学系研究科 神経内科学
4.大阪大学大学院医学系研究科 臨床遺伝学
5.新潟大学脳研究所 脳神経内科学
6.オリンパス株式会社
7.国立精神・神経医療研究センター病院 臨床検査部
8.東京医科歯科大学 脳統合機能研究センター
9.名古屋大学大学院医学系研究科 脳神経病態制御学 神経内科学
10.筑波大学 数理物質系 物理工学域
なお、本研究は、AMED革新的医療技術創出拠点プロジェクト、AMED難治性疾患実用化研究事業、およびJST戦略的創造研究推進事業の一環として行われました。
L-アルギニンはサプリメントとして市販されておりますが、本研究で使用しているものとは用法、用量が異なるため、患者様がご自身で服用されることのないようお願い申し上げます。
研究者のコメント(永井義隆寄附講座教授)
私がポリグルタミンタンパク質の凝集阻害化合物が治療薬候補になると考え、化合物スクリーニングをスタートしてから15年以上の歳月がかかってしまいましたが、既存薬でありかつ生体内の生理物質であるL-アルギニンを見つけることができ、研究を進めて行きました。異常タンパク質の凝集・蓄積は、ポリグルタミン病に限らず多くの神経変性疾患で共通に認めますので、タンパク質凝集阻害薬は多くの神経変性疾患に広く有効な治療薬となることを期待しています。
参考URL
大阪大学 大学院医学系研究科 神経難病認知症探索治療学HP
http://www2.med.osaka-u.ac.jp/neurother/
用語説明
- ポリグルタミン病
原因遺伝子内のグルタミンをコードするCAG配列の繰り返し回数の異常伸長(40回以上、健常人では35回以下)という共通の遺伝子変異を原因とする神経変性疾患の総称。様々なタイプの家族性脊髄小脳変性症(脊髄小脳失調症1、2、3、6、7、17型、歯状核赤核淡蒼球ルイ体萎縮症)やハンチントン病、球脊髄性筋萎縮症の9疾患が含まれ、わが国では約1万人のポリグルタミン病の患者さんがいると推定されている。変異遺伝子から異常伸長したポリグルタミン鎖を持つ変異タンパク質が産生され、この異常伸長ポリグルタミンタンパク質が凝集体を形成して、脳神経細胞内に蓄積し、神経変性を引き起こすと考えられている。このような異常タンパク質の凝集と蓄積はポリグルタミン病以外の他の神経変性疾患(アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症など)にも認められることから、神経変性疾患全般に共通する発症機序であると考えられている。
- 脊髄小脳変性症
小脳や脊髄をはじめとする様々な脳の領域の神経細胞が進行性に変性・脱落し、運動失調(歩行時のふらつき、手指がうまく使えない、ろれつが回らないなど)をはじめとして、痙性対麻痺(下肢の突っ張り、歩きにくさなど)、パーキンソニズム(動作がゆっくりになる、筋肉のこわばりなど)、末梢神経障害(手足のしびれなど)など様々な神経症状がゆっくりと出現し、進行する神経変性疾患の総称。わが国の患者数は約3万人と推定されており、そのうち約1/3が家族性、約2/3が孤発性(家族歴がない)である。家族性脊髄小脳変性症の約2/3(脊髄小脳失調症1、2、3、6、7、17型と歯状核赤核淡蒼球ルイ体萎縮症)がポリグルタミン病に該当する。いずれも現時点では有効な治療法に乏しく、一刻も早い治療法の開発が望まれている。
- 化学シャペロン
タンパク質の立体構造を安定化させる作用をもつ化合物の総称。
- βシート構造
タンパク質の二次構造の一つで、二本以上のアミノ酸の鎖が互いに平行に並んで形成するシート状の構造。アミノ酸の鎖の向きによって、平行の場合と逆平行の場合がある。
- αヘリックス構造
タンパク質の二次構造の一つで、一本のアミノ酸の鎖が形成する規則的ならせん構造。7アミノ酸残基ごとに約2回転のらせん構造が形成される。
- 血液脳関門
血液と脳の間でのさまざまな物質の行き来を制限する仕組み。脳内に不要な物質が侵入するのを防ぐには有用であるが、ほとんどの薬剤が血液中から脳内に移行できないため、治療薬開発の上で障壁となることが多い。
