世界初!葉緑体成立の謎を解明
タンパク質の分解係からタンパク質の運び屋に
研究成果のポイント
・葉緑体成立 に不可欠であったタンパク質輸送モーター を発見。驚くべきことに、それは、タンパク質を分解する酵素から進化したものであった。
・2013年に当グループが世界に先駆けて新奇な葉緑体タンパク質輸送チャネル を発見。この輸送チャネルと共に働く輸送モーターを探索することで今回の発見へと繋がった。
・タンパク質輸送装置の変遷を詳しく調べることで、藻類や植物の葉緑体の進化の過程を辿ることが可能。また、植物や藻類をタンパク質工場として用いる際に、光合成の場である葉緑体へ多くの異種タンパク質を集積させる技術への応用にも期待。
概要
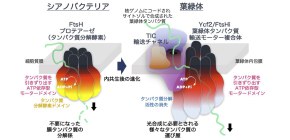
大阪大学蛋白質研究所の中井正人准教授らの研究グループは、茨城大学の中平洋一准教授、京都府立大学の椎名隆教授らとの共同研究によって、植物葉緑体で機能する2千種類を超える様々なタンパク質を葉緑体内へと運び入れる新奇で巨大な蛋白質輸送モーター複合体を見出し、その全ての構成因子を決定することに世界で初めて成功しました (図1) 。
10億年以上前、内共生したシアノバクテリアから葉緑体が成立する過程においては、葉緑体の外で合成されるタンパク質を葉緑体内へと運び入れる分子メカニズムの確立が必要でした。2013年に、中井准教授らのグループは、タンパク質を葉緑体に運び入れるために必須の新奇な輸送チャネル複合体を、葉緑体を包む膜に見出していましたが(サイエンス誌掲載済 )、このチャネルを通してATPの加水分解エネルギー依存的にタンパク質を引き込むための輸送モーターについては解明されていませんでした。
今回、中井准教授らのグループは、輸送チャネル複合体と協調的に働く分子装置を探索することにより、7つの異なるタンパク質分子から構成される、分子量およそ200万のまったく新奇で巨大な輸送モーター複合体の単離と同定に成功しました。その結果、元来、シアノバクテリアではタンパク質を分解する酵素として使われていた複合体が、葉緑体となる過程で、タンパク質を運び入れる装置へと変化して利用されてきたことが分かりました (図2) 。葉緑体成立の謎がまたひとつ解明されたことになります。
これにより、葉緑体が光合成などの機能を発揮するために必要とされるタンパク質をいかに運んでいるかの詳細な分子メカニズムの理解に大きく前進すると同時に、藻類や植物といった葉緑体を有する様々な光合成生物の進化の過程がさらに解明されていくことが期待されます。また、植物工場としての葉緑体へ、異種タンパク質を集積させる技術への応用展開も期待されます。
本研究成果は、米国科学誌「The Plant Cell」オンライン版に、BREAKTHROUGH REPORTとして10月12日(金)午前6時(日本時間)に公開されました。
図1 新奇なATP依存型の葉緑体のタンパク質輸送モーター複合体が同定された。
図2 葉緑体のタンパク質輸送モーターは、不要になったタンパク質を分解する酵素から進化したものである。
研究の背景
藻類や植物の葉緑体は光合成を行うことで地球上の生物を支えています。葉緑体は10億年以上前に、シアノバクテリアという光合成を行う細菌が宿主の真核細胞に細胞内共生したことに起源があります。進化の過程で、内共生体の遺伝子の多くは宿主の核へと転移し、葉緑体の外、細胞質ゾルでタンパク質に合成されるようになります。これと同時に、これらのタンパク質を葉緑体へと運び入れて、葉緑体内で働けるようにするタンパク質輸送装置が、葉緑体を包む膜に進化してきました。現在の植物では、2000種類を超える葉緑体タンパク質が、葉緑体の外で合成された後、正しく運ばれることで葉緑体の光合成機能を支えています。したがって、このタンパク質輸送装置がなければ葉緑体は発達せず、また植物も育つことができません。
これまで、葉緑体を包む膜には、ATPの加水分解エネルギーを利用してタンパク質を運び入れる輸送装置が存在する事は提唱されていました。2013年に、中井准教授らのグループは、葉緑体を包む膜に分子量およそ100万もの大きな複合体が存在し、これが葉緑体タンパク質を通す膜チャネルであることを、世界に先駆けて報告しました。しかし、この膜チャネルと共に、ATPの加水分解エネルギーを利用して実際にタンパク質を運び込む輸送モーターの実体に関しては不明のままでした。
中井准教授らの研究グループでは、輸送チャネルと協働してタンパク質輸送に関与する因子を探索することで、7つの異なるタンパク質から構成される分子量およそ200万のまったく新奇で巨大な輸送モーター複合体を発見しました。この複合体はAAA型ATPase ファミリーに属し、元来シアノバクテリアにおいては、不要な膜タンパク質をATPの加水分解エネルギーを利用して膜から引きずり出し、分解する酵素として働いているものでした。内共生後、葉緑体が成立する進化の過程で、この複合体から、タンパク質を分解する活性のみが失われ、ATPの加水分解エネルギーを利用してタンパク質を引きずり出す活性の部分が保持され、タンパク質輸送チャネル(TIC)と機能的に結びつくことで、葉緑体タンパク質を外から運び入れる役割を担うように変化してきたことが分かりました。
さらに驚いたことには、この輸送モーターの必須構成因子のひとつは、葉緑体ゲノムで一つ残されていた機能未知の大きな遺伝子ycf2にコードされていました。2013年に報告した輸送チャネルには同じく葉緑体ゲノムのycf1という必須遺伝子産物が含まれていましたが、どちらの遺伝子も、葉緑体進化の過程で共に大きな変化を遂げて来たことが分かりました。通常、葉緑体ゲノムは進化の過程で遺伝子が核に移行したり失われたりして退縮していく方向に進みます。しかし、ycf1やycf2の場合は、葉緑体ゲノム自身がこれら輸送チャネルと輸送モーターの中核となる遺伝子を変化させることで、核コードの葉緑体蛋白質を効率よく運び込めるように進化してきたことを意味しています。今回の研究では、輸送チャネルと輸送モーター複合体の変遷過程を詳しく調べることで、葉緑体の進化の過程と藻類や植物の進化の過程を結びつけて考察できることも示しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、10億年以上前にシアノバクテリアの内共生が成立してから、葉緑体がどのように数千種類もの異なったタンパク質を運び入れることができるようになったのか、その進化と詳細な分子メカニズムの全容解明に一歩近づいたと言えます。生体膜を隔ててタンパク質を輸送する分子装置は細胞構築原理の根幹をなすもので、その一つが解明されたことになります。また、今回見出されたタンパク質輸送装置の変遷を詳しく調べることで、葉緑体の変化も含めて藻類や植物の進化の過程を辿ることも可能になりました。応用面では、植物や藻類を有用タンパク質の製造工場として用いる場合、葉緑体にさまざまな異種タンパク質を集積させて機能させるために、今回のタンパク質輸送装置に関する知見が役に立つことが期待されます。
特記事項
本研究成果は、2018年10月12日(金)午前6時(日本時間)に米国科学誌「The Plant Cell」(オンライン)に、ブレークスルーレポート(BREAKTHROUGH REPORT)として掲載されました。
タイトル:“A Ycf2-FtsHi heteromeric AAA-ATPase complex is required for chloroplast protein import”
著者名:Shingo Kikuchi, Yukari Asakura, Midori Imai, Yoichi Nakahira, Yoshiko Kotani, Yasuyuki Hashiguchi, Yumi Nakai, Kazuaki Takafuji, Jocelyn Bédard, Yoshino Hirabayashi-Ishioka, Hitoshi Mori, Takashi Shiina, Masato Nakai*(*責任著者)
フリーオンラインアクセス: https://doi.org/10.1105/tpc.18.00357
本研究は、大阪大学蛋白質研究所の中井准教授グループを中心として、茨城大学、京都府立大学に加えて、大阪医科大学、名古屋大学との共同研究として行われました。なお、本研究の一部は、文部科学省科学研究費補助金新学術領域研究「新光合成:光エネルギー変換システムの再最適化」「新生鎖の生物学」「マトリョーシカ型進化原理」の支援を受けて行われました。
研究者のコメント
葉緑体のタンパク質輸送装置に関しては、10年以上前から提唱されている古いモデルが定着していました。われわれのグループでは、この定説に疑問を持ち、2013年に新奇なタンパク質輸送チャネルを発見しサイエンス誌に発表しています。今回報告する新奇な輸送モーターはそれに次ぐ発見であり、これらの発見により、教科書にも載っているような古い定説は覆され、モデルは大幅に書き換えられる事になると考えています。今回の論文発表においては、科学的根拠とは別のところで古い学説を信じている査読者を納得させる事に実に3年に及ぶ長い時間を費やしましたが、最後は実験データの正しさが認められたと思います。また、葉緑体ゲノムのycf1とycf2という遺伝子は長い間、葉緑体研究者の間で機能未知の謎の遺伝子として知られていましたが、われわれの2013年と今回の報告により、その実体が解明されたことになります。輸送チャネルと輸送モーターの鍵となるコンポーネントとして、葉緑体自身がycf1とycf2という2つの遺伝子を協調的に変化させながら進化してきたことに、私たちも大変驚きました。
参考URL
大阪大学 蛋白質研究所 蛋白質化学研究部門
http://www.protein.osaka-u.ac.jp/enzymology/index.html
用語説明
- 葉緑体成立
葉緑体は、酸素発生型の光合成を営むシアノバクテリアの一種が、既にミトコンドリアや核を有していた真核細胞に内共生したことに起源を有すると考えられている。内共生体が、細胞内構造体である葉緑体として成立するためには、細胞分裂に伴って正しく受け継がれていく機構だけでなく、タンパク質など様々な分子を葉緑体内へ輸送する分子機構の確立が必要であったと考えられる。
- タンパク質輸送モーター
タンパク質のような高分子が生体膜を一方向に通過するには、通過するための孔(チャネル)だけでは不十分で、何らかのエネルギーを必要とする。多くの場合、輸送チャネルと共役して働くタンパク質が輸送すべきタンパク質を捉え、さらにATPの加水分解エネルギーを利用して構造変化を起こすことで、タンパク質の一方向の輸送を導く。このような仕組みをタンパク質輸送モーターと呼ぶ。
- タンパク質輸送チャネル
タンパク質が生体膜を通過するために通るための孔(チャネル)。トランスロコンとも呼ばれ、多くの場合、複数のサブユニットからなる膜タンパク質複合体である。生命は長い進化の過程で、細胞を構成する膜にそれぞれ特異的なタンパク質輸送チャネルを進化させてきた。バクテリア型のSECやミトコンドリアのTOMやTIM、ペルオキシソームのPEXなどがそれにあたる。それらは、構成因子も分子メカニズムも異なっているが、付随するタンパク質輸送モーターも独自のものを使う。葉緑体のTICや今回見出されたYcf2/FtsHi輸送モーターも葉緑体内包膜に特有のものである。
- サイエンス誌掲載済
タイトル:Uncovering the Protein Translocon at the Chloroplast Inner Envelope Membrane. (2013) Science 339, 571-574. 著者名:Shingo Kikuchi, Jocelyn Bédard, Minako Hirano, Yoshino Hirabayashi, Maya Oishi, Midori Imai, Mai Takase, Toru Ide, & Masato Nakai
- AAA型ATPas
細胞は、ATP(アデノシン三リン酸)の末端のリン酸結合を加水分解する際に発生するエネルギーを様々な生命活動に利用しているが、このようなATP加水分解酵素をATPaseと呼ぶ。ATPaseは、その構造や作用機作の違いからいくつかのグループに分けられ、そのひとつがAAA-ATPaseと呼ばれる一群のタンパク質である。AAAは、ATPase Associated with diverse cellular Activitiesの略称であり、このグループに属するタンパク質は、タンパク質の分解や輸送、DNA複製や膜融合といった細胞内の多様な活動に関与している。200-250アミノ酸残基からなるATPase部分を共通に持つが、分解に関わるものは分解酵素の部分も併せ持つなど、それぞれの機能に応じたアミノ酸配列と組み合わされて機能する。AAA-ATPaseの多くは、6量体のリング構造を取り、6つの各サブユニットがATP加水分解に伴った構造変化を順次繰り返すことで(ATP依存型モーターと呼ぶ)、リング中に取り込んだタンパク質やDNAの輸送やリモデリングを司る。
