炎症はアクセルとブレーキのバランスを変化させる
炎症過程におけるRNA安定化分子の局在制御メカニズムを解明
研究成果のポイント
・Arid5a が過剰に発現するマウスでは、炎症過程で、インターロイキン6(IL-6) が過剰に産生され、敗血症性ショックが悪化する。
・今回、Arid5aが炎症応答により細胞核から細胞質に移行することを発見した。
・今後、Arid5aの核外移行を阻害することで、IL-6の減少を誘導し、敗血症性ショックや自己免疫疾患を抑えることができる可能性。
概要
大阪大学免疫学フロンティア研究センター免疫機能統御学の岸本忠三特任教授(元大阪大学総長)らの研究グループは、Arid5aと呼ばれるRNA安定化分子の動的細胞内局在による炎症応答の制御機構を解明しました。
炎症のアクセル役のArid5aは主に核に局在し、ブレーキ役のRegnase-1 は細胞質に局在しています。
本研究では、①炎症応答によりArid5aが核から細胞質に移行すること、②Importin-α 結合を阻害するペプチドを細胞内に強制発現させることで、Arid5aの核内輸送が阻害されること、③核外輸送分子CRM1阻害剤、レプトマイシンB 症応答後のArid5aの核外移行を阻害することを明らかにしました (図1) 。
本研究は、過剰的もしくは慢性炎症で生じる疾患の病態解明の手掛かりになり、Arid5aの核外移行の阻害は、炎症性サイトカインの1つであるインターロイキン6の減少をもたらすことから、新たな治療法の開発に繋がることが期待されます。
本研究成果は、Proceedings of the National Academy of Sciences of USA (PNAS) 米科学アカデミー紀要に2018年1月23日(日本時間)オンライン掲載されました。
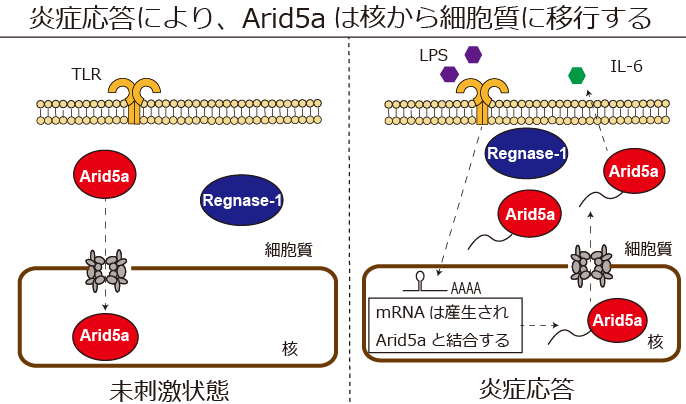
図1 RNA安定化分子Arid5aは核内輸送分子Importin-α/β1経路を介して、核内に移行する。RNA分解分子Regnase-1は細胞質に局在する。細菌の外膜の成分でもあるLPSは炎症応答を引き起こす。その後、Arid5aはmRNAと結合し、核外輸送分子CRM1経路を介して、細胞質に移行する。Arid5aが細胞質に移行することで、炎症は促進する。
研究の背景
免疫細胞は病原体を排除するために、IL-6やTNFを代表とする炎症性サイトカインというタンパク質を分泌し、これが周りの免疫細胞を活性化させることで炎症を誘導させます。しかしながら、過剰、もしくは慢性化した炎症は敗血症性ショック、自己免疫疾患などの様々な病気の原因となるため、生体には、炎症をコントロールする機構が備わっています。その機構の中に、炎症を促進させるArid5aというタンパク質と炎症を抑制させるRegnase-1というタンパク質があります。これまで、Arid5aがIl6mRNAの3′UTRに結合し、Regnase-1によるRNA分解作用を阻害すること、Arid5aを欠損させたマウスでは、炎症を誘導させたにも関わらず、炎症性サイトカインの産生が減少し、敗血症性ショック、肺の線維化が抑えられることが分かっていましたが、未刺激や炎症応答時におけるArid5aの作用については未だ不明な点がありました。
研究内容
「Arid5aを過剰に発現させるのみで、IL-6が過剰に産生され、炎症性疾患を誘発する」という仮説の下、研究に取り組みました。検証するために、我々はArid5a過剰発現マウスを作製しました。当初の予測に反し、健常時では、IL-6の産生への影響は確認されませんでしたが、炎症応答により、Arid5a過剰発現マウスでは、よりIL-6が産生され、敗血症性ショックが悪化することが示されました (図2) 。つまり、Arid5aは刺激依存的に機能を発揮することが分かりました。我々は、未刺激時と刺激時におけるArid5aの細胞生物学的作用を解明するためにさらに研究を推進させました。
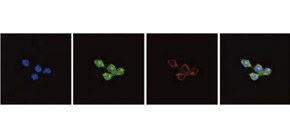
RAW264.7細胞(マウスマクロファージ様細胞株)における、内在性Arid5aとRegnase-1のタンパク質局在を確認しました。その結果、Arid5aは主に核内に局在し、Regnase-1は細胞質に局在することを確認しました (図3) 。次に、どのような制御機構でArid5aが核の中に移行するのかを解析しました。その結果、RAW264.7細胞に、Importin-αと輸送されるタンパク質の結合を阻害するアミノ酸配列(bimax)を発現させるとArid5aの核内移行が阻害されることを確認しました。つまり、Arid5aはImportin-α/β1経路を介して核内に移行しているということが示唆されました。
また、炎症応答後のArid5aの核₋細胞質間の変化を調べました。方法として、LPS刺激後にRAW264.7細胞を核-細胞質に分画し、その後、ウエスタンブロッティングを行うことで、Arid5aがどのように変化するのかを確認しました。その結果、LPS刺激後、核内のArid5aは減少し、細胞質内のArid5aは増加することを発見しました (図4) 。
さらに、炎症応答後におけるArid5aの核外移行について調べることにしました。その結果、核外輸送因子CRM1の阻害剤、レプトマイシンBを加えると、刺激後に起こるArid5aの核外移行が阻害され、IL-6の産生は減少しました。
以上の結果から、Arid5aはImportin-α/β1経路を介して、核内に移行し、その後、炎症応答により、CRM1経路を介して、核外に移行することが明らかになりました。
未刺激状態では、炎症のアクセル役であるArid5aは核内に局在し、ブレーキ役のRegnase-1は細胞質に局在することで、不必要なIL-6の産生は抑えられています。しかしながら、IL-6は免疫を活性化するために必要なものです。従って、炎症応答後、Arid5aはIl6 mRNAと核内で結合し、分解機構を阻害するために細胞質に移行することが考えられます。Arid5aの細胞質移行が炎症を促進するために重要であるということが示唆されました。
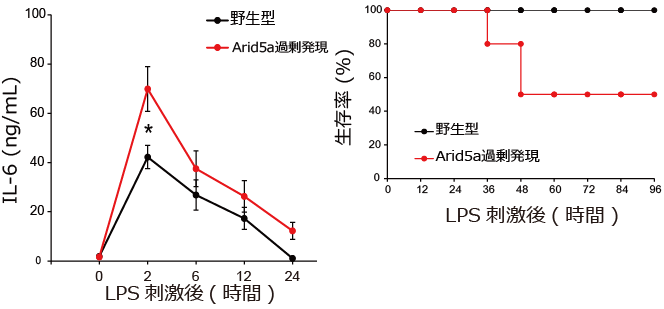
図2 Arid5aの過剰発現マウスはLPS刺激後、よりIL-6が産生され、敗血症性ショックは悪化する
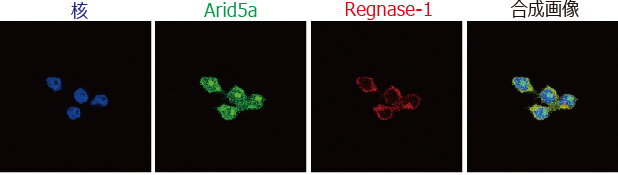
図3 内在性のArid5aのRegnase-1のタンパク質局在
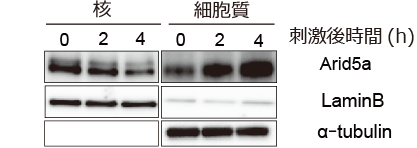
図4 Arid5aはLPS刺激後に核内で減少し、細胞質で増加する
今後の展開
関節リウマチをはじめとする多くの自己免疫疾患では、患者の血液中に炎症性サイトカイン「IL-6」の顕著な増加(異常産生)が認められています。また、IL-6受容体に対する抗体「トシリズマブ」はIL-6の信号をブロックすることにより、関節リウマチをはじめとする多くの疾患の治療に画期的な効果を発揮しています。
本研究で岸本特任教授らの研究グループは、Arid5aが炎症応答により核から細胞質に移行することを発見しました。今後、Arid5a の核外移行を阻害することで、IL-6の減少を誘導し、敗血症性ショックや自己免疫疾患を抑えるという新規の治療戦略を提供できる可能性があります。
掲載論文・雑誌
“Regulation of inflammatory responses by dynamic subcellular localization of RNA binding protein Arid5a”「Arid5a の動的細胞内局在による炎症応答の制御」
Mitsuru Higa, Masahiro Oka, Yoshitaka Fujihara, Kazuya Masuda, Yoshihiro Yoneda and Tadamitsu Kishimoto * . *責任著者
Proceedings of the National Academy of Sciences of USA (PNAS) 米科学アカデミー紀要
2018年1月23日(日本時間)オンライン掲載
特記事項
本研究は、国立研究開発法人 医薬基盤・健康・栄養研究所と共同で行われました。
参考URL
大阪大学免疫学フロンティア研究センター 免疫機能統御学
http://www.ifrec.osaka-u.ac.jp/jpn/laboratory/tadamitsu_kishimoto/
用語説明
- Arid5a
(アリッド ファイブエー):
インターロイキン6(IL6)等のmRNAに結合し、RNAを安定化させるタンパク質。炎症のアクセル役を担っているタンパク質。
- インターロイキン6(IL-6)
大阪大学の岸本忠三研究室で発見された代表的な炎症性サイトカイン。特に関節リウマチの原因として有名であり、そのブロック剤は広く世界で治療薬として使われている。
- Regnase-1
(レグネース ワン):
IL6等のmRNAの分解を行うことで過剰な免疫応答のブレーキ役を担っているRNA分解タンパク質
- Importin-α
(インポーチン-アルファ):
細胞質から核膜孔を通して核内にタンパク質を運搬する最初の輸送因子。importin-αは基質とimportin-β間のアダプターとして働き、基質/importin-α/importin-βの3者の複合体を形成して、基質を核内へ輸送する。
- レプトマイシンB
核外輸送因子CRM1の特異的阻害剤である。その抗腫瘍作用などが注目されている。
