粘膜ワクチン開発に結びつく、経粘膜抗原取り込みに直接関わる分子を同定
注射器・針が不必要な経粘膜ワクチン開発に期待
本研究のポイント
・粘膜面の抗原取り込みM細胞の機能発現に直接関わる分子を同定した。
・これまで、M細胞への分化に必要な転写因子や、M細胞上の病原性細菌に対する受容体は報告されているが、抗原を取り込むときに働く分子群は同定されていなかった。
・本成果により、注射器・針が不必要な経粘膜ワクチン開発に向けて、その標的細胞のワクチン抗原取り込み機能をコントロールした経粘膜ワクチンデリバリー法の構築に繋がる事が期待される。
概要
東京大学医科学研究所の清野宏教授と大阪大学微生物病研究所の佐藤慎太郎特任准教授(常勤)らの研究グループは、粘膜面からの抗原取り込み口であるM細胞の機能発現に直接関わる分子として、Allograft inflammatory factor1(Aif1)を同定しました。
M細胞は粘膜を覆う上皮細胞の一種ですが、周辺の他の上皮細胞に比べて短くて疎な微絨毛を持っており、また、粘液を産生しないことから、管腔側の外来抗原が落とし穴に入るように取り込まれやすい状況を作り出しています。加えて、色々な微生物に対する受容体を管腔側表面に発現しており、それらの効率的な取り込みに寄与していることが報告されています。しかし、抗原を運び込むトランスサイトーシス という機能に直接関与する分子群はこれまで報告されていませんでした。
今回の研究グループの研究成果により、Aif1は細胞の運動に関与するアクチンの動きを制御することで、外来抗原取り込み時に管腔側での細胞膜を変化させていることが示唆されました。一過性にAif1の発現や機能をコントロールすることが出来れば、粘膜型ワクチン の抗原取り込み効率を上げることや、逆に病原性微生物の侵入を阻止し感染予防を可能にすることが出来ると考えられます。
研究の背景・先行研究における問題点
粘膜免疫系は全身性免疫系と比較した場合、種々の異なる特徴を持っていますが、抗原が樹状細胞などの抗原提示細胞によって補足され、その情報がナイーブなT細胞やB細胞に提示されることで免疫の活性化が起こる点は同じです。例えば、注射型ワクチンを投与すると、体の中を守る全身性免疫が動き出します。注射で投与された抗原は抗原提示細胞が補足し、輸入リンパ管を通じて体内にある末梢リンパ節内に移行し、そこで抗原提示が行われることでワクチン効果を発揮するリンパ球が誘導され、体の中を守る体制を作ります。一方で、粘膜免疫における抗原提示は主に粘膜組織に存在する粘膜関連リンパ組織(MALT)の中で行われますが、MALTには輸入リンパ管が存在しません。その代わりに、粘膜面、管腔内から直接抗原を取り込む機能を取り備えています。この抗原取り込みを主として担っていると考えられているのがM細胞です。M細胞は、MALTを覆う一層の濾胞関連上皮細胞層(FAE)の中に存在して いる上皮細胞の一種です。
M細胞は先述のように、周辺の他の上皮細胞に比べて短くて疎な微絨毛を持っており、また、粘液を産生しないことから、経口投与された抗原が落とし穴に入る様にMALT内に取り込まれやすい状況を作り出しています。M細胞はその発見から40年以上が経過していますが、その特徴や機能に関して分子レベルでの詳細な解析、報告がなされ始めたのは最近のことです。これまでに、FAE直下に存在するストローマ細胞が発現するRANKLという分子の刺激を、FAEの細胞がその受容体であるRANKを介して受け取ることで細胞内に転写因子Spi-Bの発現が誘導されてM細胞への分化が始まることが報告されています。またこの分化に伴って、現在は成熟M細胞のマーカーとして認知されているGP2の管腔側表面への発現が誘導されることがわかっています。GP2はサルモネラや大腸菌が有する鞭毛タンパク質の一種、FimHを認識することで、それらの細菌の効率的な取り込みに寄与していることも報告されています。しかし、抗原を運び込み通過させるトランスサイトーシスというM細胞の特徴的機能に直接関与する分子群はこれまで報告されていませんでした。
研究内容(具体的な手法など)
M細胞のトランスサイトーシスに直接関与する分子群を同定する目的で、当研究グループは、M細胞のほとんどを欠失するSpi-B欠損マウスとそのコントロールマウスからFAEを調整し、それらの遺伝子発現を解析、比較しました。そして、その中の候補遺伝子の一つとしてAif1を同定しました。リアルタイムPCR により、Aif1の発現が腸管上皮細胞系列ではFAEに特異的であり、かつSpi-Bに依存していることが確認できました。上記の結果がタンパク質レベルでも確認できたことから、Aif1は腸管上皮細胞系列においてはM細胞特異的発現分子である事が明らかになりました (図1) 。そこで次に、Aif1の成体内での機能を詳細に解析するために、Aif1を欠損するマウス(Aif1 KOマウス)を作製しました。Aif1 KOマウスでは、M細胞の発達・分化に影響はありませんでしたが、人工粒子や腸内共生細菌(例、乳酸菌)、病原性細菌のエルシニア・エンテロコリティカの取り込みが顕著に減弱しており、同分子がM細胞の機能に関わっている事が強く示唆されました (図2) 。
これまでにAif1は、マクロファージや樹状細胞などの物質の貪食に関わる細胞で強く発現していることが報告されていることから、Aif1 KOマウスで抗原の取り込みが減弱している理由として、これらの細胞群による貪食能が弱まった結果である可能性が残っていました。そこで、血球系ではAif1を欠損しないように、Aif1 KOマウスに野生型の骨髄を移植して(また、それとは逆のマウスを作製して)同様の解析を行いました。その結果、野生型マウスはAif1 KOマウス由来の骨髄を移植されても、変わらずに物質の取り込みをしていましたが、逆にAif1 KOマウスは野生型由来の骨髄を移植しても、物質の取り込みが改善することはありませんでした。これらの結果は、抗原の取り込みにはM細胞中でAif1が発現し機能することが重要で、樹状細胞などの血球系細胞の影響はほとんどないことを意味するものです。
病原性細菌の一つであるエルシニア属のM細胞を介した侵入には、β1インテグリンがエルシニアを補足する足場として機能することがこれまでに報告されていました。そこで、Aif1がβ1インテグリンの発現、ないしは活性化にも寄与しているのではないかと考え、全てのβ1インテグリン、活性型β1インテグリン、それぞれに対する2種類の抗体を用いて野生型マウスとAif1 KOマウスのFAEを染色してみました。その結果、β1インテグリンの発現は両マウスで同程度確認できましたが、活性型β1インテグリンの発現はAif1 KOマウスで全く認められませんでした。このβ1インテグリンの活性化には、カルシウムイオン依存的なスモールGTPアーゼの活性化が必須です。これまでに我々の研究グループは、スモールGTPアーゼの中ではRac2がM細胞特異的に強く発現することを報告しています。この事実と、Aif1がカルシウムイオン結合能を有するEF-handモチーフを有していることから、M細胞内ではAif1-Rac2のシグナル伝達がβ1インテグリンの活性化に寄与しているであろうと予測しています。また、Aif1-Rac2シグナルはアクチンの再構成に関与していることも報告されていることから、このシグナル伝達系がM細胞のトランスサイトーシスを実現するのに必須なものであると考えています (図3) 。
社会的意義・今後の予定
今回の研究成果により、機能性分子であるAif1はアクチンの動きを制御することで、外来抗原取り込み時に管腔側での細胞膜を変化させていることが示唆されました。一過性にAif1の発現や機能をコントロールすることが出来れば、粘膜型ワクチンの抗原取り込み効率を上げることや、逆に病原性細菌の感染予防を可能にすることが出来ると考えられます。その一方で、Aif1以外のM細胞機能関連分子群の存在を示唆する結果も得ており、このことから抗原取り込み能に寄与する分子が複数存在することが予想されます。今後もM細胞特異的に発現する分子を同定し、その機能を検証する事で、M細胞による抗原取り込み能の全容を解明する必要があると考えています。
発表雑誌
雑誌名:Nature Communications(2月22日オンライン版)
論文タイトル:Allograft inflammatory factor 1 is a regulator of transcytosis in M cells
著者:岸川咲吏、佐藤慎太郎*、金戸聡、内野茂夫、高坂新一、中村誠司、清野宏*
DOI番号:10.1038/ncomms14509
参考図
図1~3URL
http://www.biken.osaka-u.ac.jp/lab/mucosal/ncssfig1
http://www.biken.osaka-u.ac.jp/lab/mucosal/ncssfig2
http://www.biken.osaka-u.ac.jp/lab/mucosal/ncssfig3
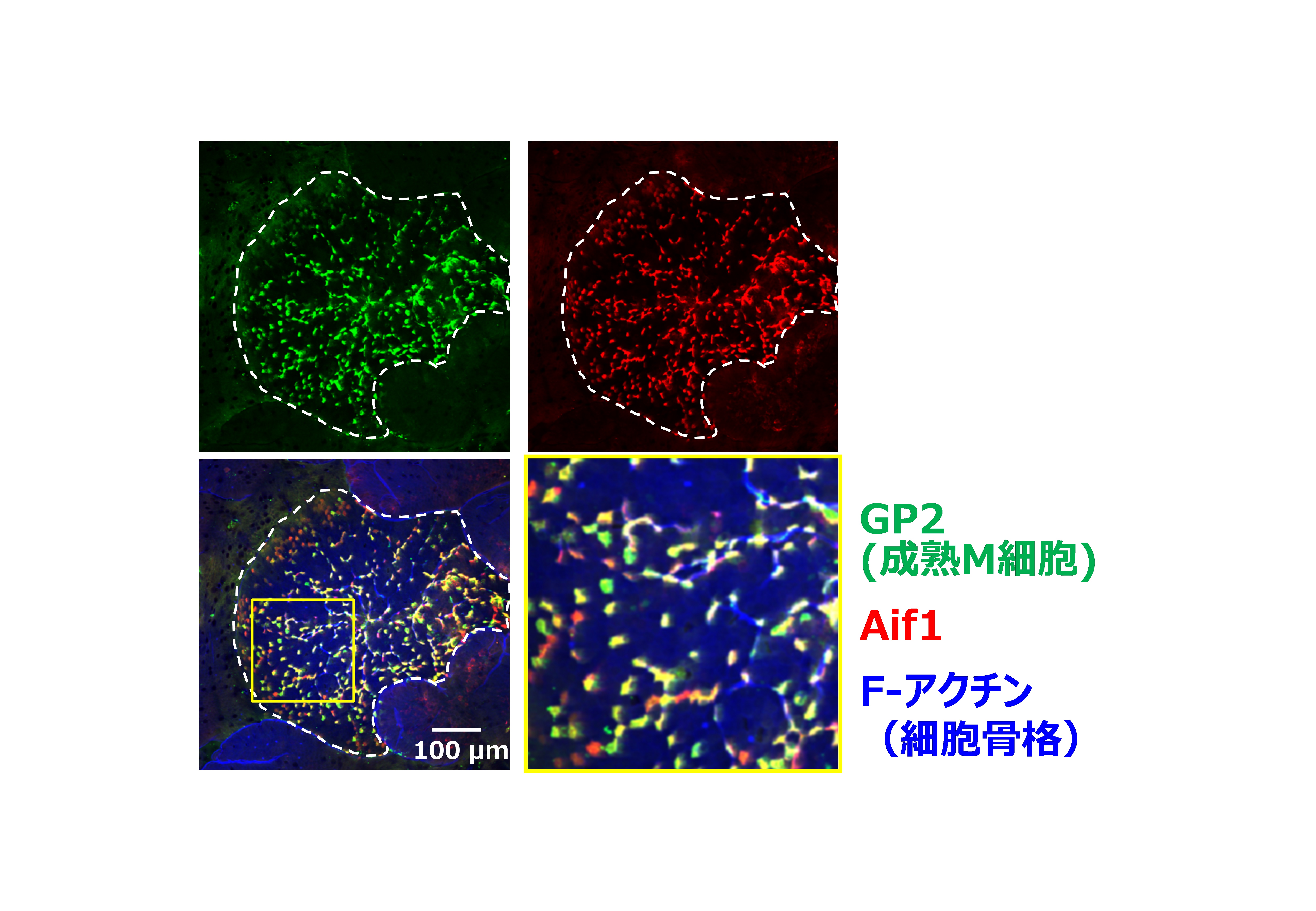
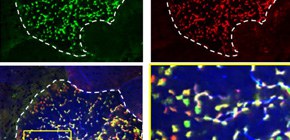
図1 Aif1は成熟M細胞特異的に発現している
野生型マウスのFAEを管腔側から観察した図。Aif1(赤)は成熟M細胞(緑)においてのみ認められる。
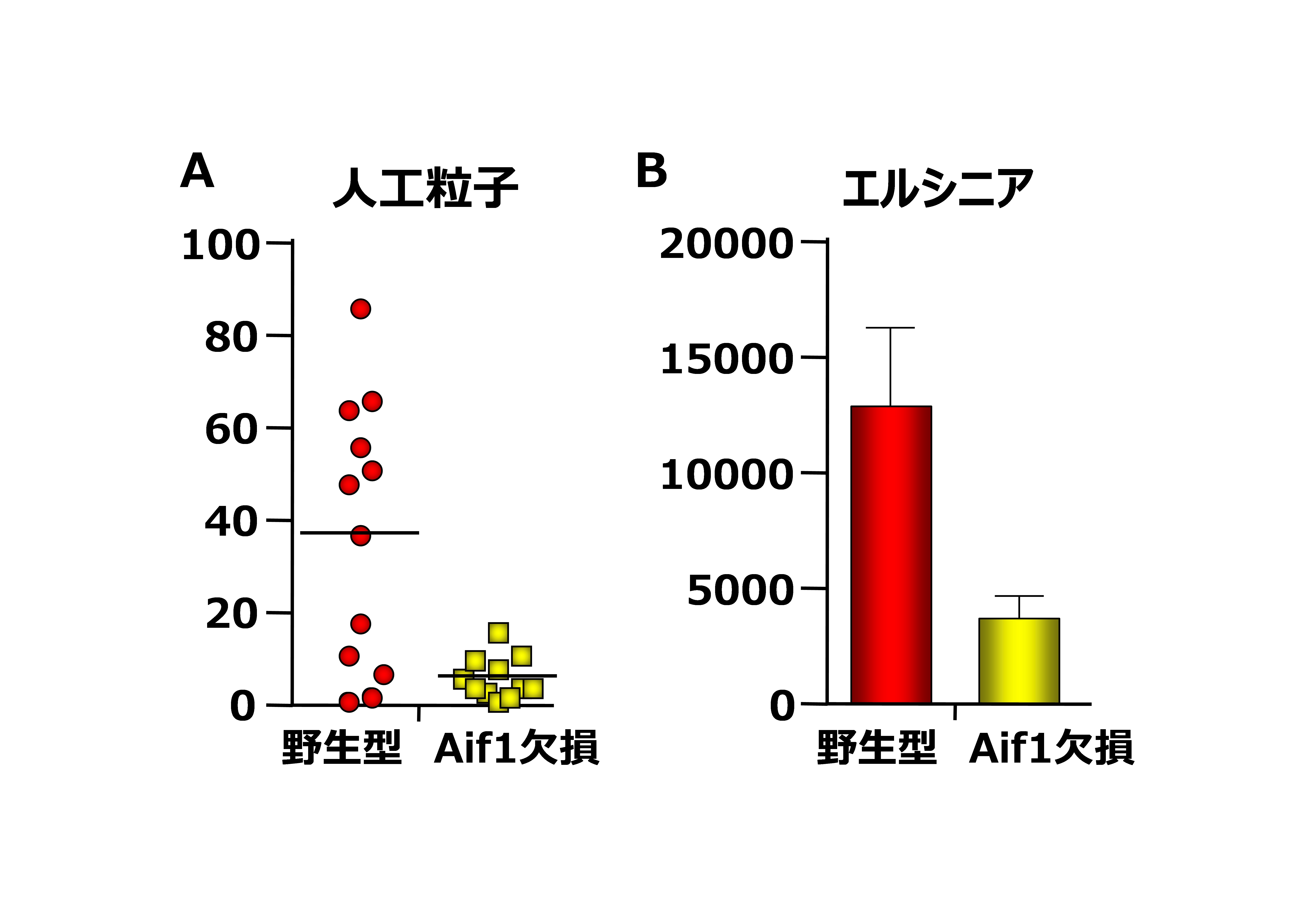
図2 Aif1欠損マウスではトランスサイトーシス能が低下している
野生型マウスとAif1欠損マウスに直径200nmの人工粒子(A)、またはエルシニア(B)を経口投与し、パイエル板内に取り込まれた数を計測、比較した。Aif1欠損マウスではどちらの取り込みも野生型マウスに比べ減少していた。
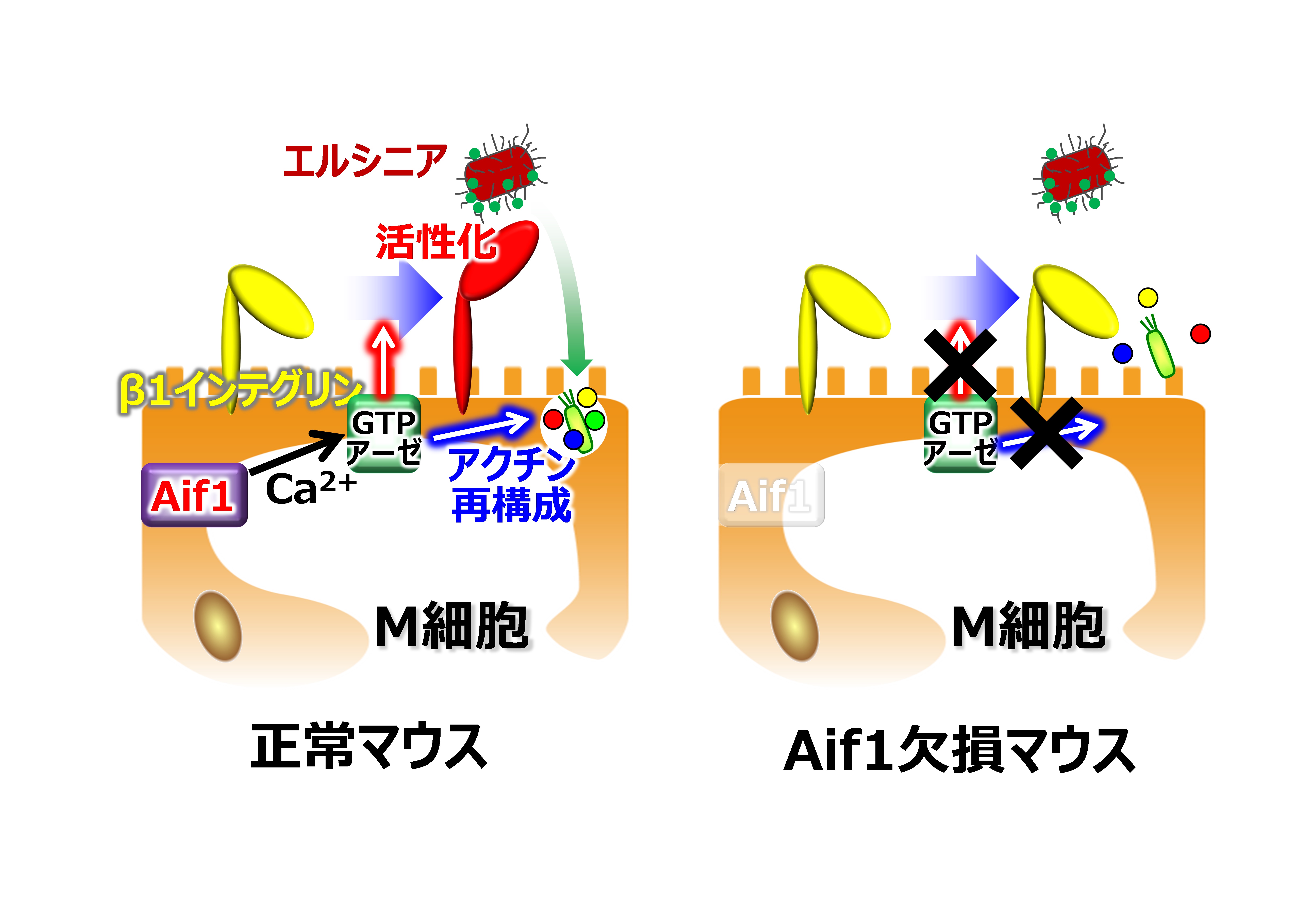
図3 Aif1 の M 細胞における機能
Aif1はカルシウムイオン(Ca2+)結合能を有しており、GTPアーゼを活性化することができる。活性化したGTPアーゼはM細胞の管腔側でβ1インテグリンを活性化し、エルシニアの受容体として機能させると共に、アクチン再構成を引き起こし、細胞膜が変化してトランスサイトーシスを誘導する。Aif1欠損マウスではどちらの反応も起こらず、抗原取り込みは減弱する。
参考URL
微生物病研究所・BIKEN次世代ワクチン協働研究所 粘膜ワクチンプロジェクト
http://www.biken.osaka-u.ac.jp/lab/mucosal/index.html
用語説明
- トランスサイトーシス
上皮細胞などが細胞外に存在する物質をエンドサイトーシスにより細胞内へ取り込み、その後反対側へエキソサイトーシスにより放出する現象。M細胞では、管腔側から物質(抗原)が取り込まれ、基底膜側へ速やかに放出される。
- 粘膜型ワクチン
従来の注射型のワクチンに代わる、粘膜を介して作用するワクチンの総称。注射型ワクチンは体内に侵入してきた病原体に対しては効果を発揮するが、ほとんどの感染症原因微生物の侵入口である 消化器や呼吸器、生殖器といった粘膜面においては免疫が誘導されず、無防備な状態である。粘膜型ワクチンの場合は、体内はもとより、粘膜面においても免疫が誘導されるため、病原性微生物の侵入そのものを防ぐこともできる。また、注射針を必要としないため、ワクチン投与時の幼児の負担軽減や誤刺などの医療事故を減らす利点もある。
- リアルタイムPCR
ポリメラーゼ連鎖反応(PCR)を用いた、サンプル中に含まれる特定の遺伝子を定量する実験方法。
