ガンの浸潤や骨粗鬆症の原因となるタンパク質の働きを阻害するペプチドを創製
新薬設計時の新たな作用領域として期待
本研究成果のポイント
・ガンの転移(浸潤)にかかわるSema4D(セマフォリン4D) -PlxnB1(プレキシンB1) 相互作用を阻害するアミノ酸である中分子化合物環状ペプチド の取得に成功
・Sema4D-PlxnB1結合面は広く浅く、低分子化合物がはまる凹凸がないため、薬物設計することは困難だった
・ガンの浸潤や骨粗鬆症に関する新薬設計時の新たなターゲット領域として役立つことに期待
概要
大阪大学蛋白質研究所の高木淳一教授のグループは、東京大学大学院理学系研究科の菅裕明教授のグループと共同で、臓器形成や免疫応答を司る中心的なタンパク質であり、ガンの浸潤にもかかわるSema4D(セマフォリン4D)の受容体、PlxnB1(プレキシンB1)へ強く結合する環状ペプチドPB1m6の取得に成功しました。そして、そのPB1m6がPlxnB1の機能を阻害することを証明しました。PlxnB1はSema4Dと結合することでシグナル伝達を引き起こす膜タンパク質であり、ガンや骨粗鬆症を含むさまざまな疾患に関わっています。
通常、Sema4D-PlxnB1のようなタンパク質-タンパク質間の結合面は広く平坦で、低分子化合物がはまり込むような窪みも無く、両者間の結合を阻害する化合物をデザインすることは至難の業でした。
本研究で得られた環状ペプチドPB1m6は、Sema4Dとの結合面から遠く離れた領域へ結合することでSema4D-PlxnB1間の結合力を弱め、結果としてSema4D-PlxnB1による生物活性を完全に阻害しました。このような効果をアロステリック効果と呼び、PB1m6はPlxnB1のアロステリックインヒビターであるといえます。PlxnB1上のPB1m6結合部位、すなわち、アロステリック部位が、抗セマフォリン-プレキシン創薬にとって新たなターゲット領域となることが期待されるとともに、環状ペプチドが中分子創薬の研究開発において重要な位置を占めることが予測されます。
本成果は米科学誌「Cell Chemical Biology」に10月27日付けでオンライン掲載されました。
研究の背景
セマフォリン(ヒトには21種類のセマフォリンが存在します)は、当初、発生期の神経形成時に神経軸索の伸長方向を導くガイダンス因子として同定されましたが、現在では、神経形成だけでなく臓器形成や免疫応答を司る中心的なタンパク質であることが分かっています。セマフォリンのシグナルを伝える主要な受容体として、プレキシン(ヒトには9種類のプレキシンが存在します)という膜タンパク質が知られています。これらセマフォリン(リガンド)とプレキシン(受容体)ファミリー分子群の間で、数多くのリガンド-受容体の結合ペアが作られます。中でもSema4D-PlxnB1の結合ペアが引き起こす細胞内のシグナル応答は、がん細胞の浸潤を促進したり、骨量の低下を引き起こしたりすることが報告されているため、このシグナル伝達経路を阻害することは、がんや骨粗鬆症の治療にとって有用であると考えられています。
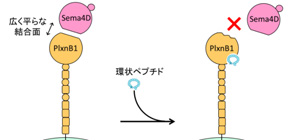
しかしながら、セマフォリン-プレキシンのような典型的なタンパク質-タンパク質間の結合面をターゲットにした薬剤設計は非常に難しいことが知られています。なぜならば、そのようなタンパク質間の結合表面は非常に広く浅く、低分子化合物がはまり込むような小さくて深いポケットが存在せず、もしたとえ一箇所の結合を邪魔したとしても他点で補われてしまうことも考えられるからです( 図1 、左)。
図1 環状ペプチドによるアロステリック阻害作用の模式図
研究の成果
高木グループの松永幸子特任助教(常勤)は、菅グループのNasir K. Bashiruddin博士研究員と共同で、菅グループが樹立した特殊環状ペプチドライブラリー『RaPIDシステム』を駆使し、PlxnB1に結合する環状ペプチドの探索を試み、PB1m6の取得に成功しました。この環状ペプチドPB1m6は、たった15残基のアミノ酸から構成されるにもかかわらず、ヒト由来のPlxnB1のみを認識し、マウス由来PlxnB1や他のプレキシンファミリータンパク質群をほとんど認識せず、まるで抗体のような高い結合特異性を持つことが分かりました (図2) 。
X線結晶構造解析と機能解析の結果、環状ペプチドPB1m6は、Sema4D-PlxnB1間の結合を直接阻害するわけではなく、その結合面から遠く離れている領域へ結合するにもかかわらず、Sema4D-PlxnB1間の結合力を弱めることを明らかにしました。タンパク質の構造が他の分子の結合によって変化して機能調節されることをアロステリックといい、つまりPB1m6は、PlxnB1のアロステリック部位へ結合することでSema4Dとの結合面に構造変化を引き起こし、PlxnB1を介した生物活性を阻害したと考えられます( 図1 、右)。このようなPlxnB1におけるアロステリックな調節機構がプレキシンファミリータンパク質群に普遍的なものであるとすると、本研究成果は、まさにセマフォリン-プレキシン制御薬の開発のための新たなターゲット領域(アロステリック部位)を見出したと言えます。
図2 環状ペプチドPB1m6-biotinは、ヒトPlxnB1のみを認識し結合した
(結合するとヒストグラムのピークは右へシフトする)
本研究成果が社会に与える影響(本研究成果の意義)
現在市場に出回る医薬品は酵素などの基質が入り込む小さくて深い活性中心のポケットをターゲットにした低分子化合物(分子量:~500)が多くを占めます。基質の構造を模した低分子の阻害化合物は比較的安価に生産可能ではありますが、本研究のような平坦なタンパク質-タンパク質間の結合面をターゲットにした場合の低分子阻害化合物の設計は非常に難しいという問題点もあります。
一方、そのような結合面をターゲットにした創薬といえば、生物医薬と称される抗体医薬品が挙げられます。それら抗体医薬品の抗原特異性は非常に高いですが、抗体は高分子(分子量:約15万)のタンパク質であるがために、生産コストが高いのみならず、製品の品質管理が難しく、非常に高価となって医療費を押し上げるという問題が指摘されています。それら両者のボトルネックを解消するために最近話題になっているのが中分子創薬であり、環状ペプチドは中分子化合物(分子量:500~数千)の一つとして注目されています。
本研究により創出された環状ペプチドPB1m6(分子量:約2千)は、非常に高い結合特異性を示し (図2) 、かつタンパク質製剤よりも安価で安定的に合成可能です。本研究成果がこれからの中分子医薬開発のさきがけとして位置し、牽引してゆく存在となることが期待されます。
特記事項
本研究成果は、米科学誌「Cell Chemical Biology」に10月27日(木)付けで掲載されました。
論文タイトル:Allosteric inhibition of a semaphorin 4D receptor plexinB1 by a high-affinity macrocyclic peptide
著者:Yukiko Matsunaga * , Nasir K. Bashiruddin * , Yu Kitago, Junichi Takagi # , and Hiroaki Suga # (*Co-first author, #Correspondence)
参考URL
蛋白質研究所附属蛋白質解析先端研究センター 分子創製学研究室
http://www.protein.osaka-u.ac.jp/rcsfp/synthesis/
用語説明
- Sema4D(セマフォリン4D)
セマフォリンは神経の伸びる方向をガイドするタンパク質であり、Sema4Dはクラス4のセマフォリンファミリーに属する。細胞外にSemaドメインとPSIドメインと呼ばれるドメイン構造を持つ膜タンパク質。プロテアーゼによる切断を受けて分泌されることが知られている。
- PlxnB1(プレキシンB1)
タイプBのプレキシンファミリーに属し、1500アミノ酸残基からなる大きな細胞外領域をもつ膜タンパク質。セマフォリンと同様にアミノ(N)末端にSemaドメイン構造を持ち、Sema4Dとお互いのSemaドメイン同士で結合する。
- 環状ペプチド
アミノ(N)末端とカルボキシ(C)末端が結ばれ環状構造をもつポリペプチド。直鎖状ペプチドよりも剛直で分子の動きが制限される。プロテアーゼにより切断されにくく、生体内で安定であるという性質を持っている。今回用いた環状ペプチドは、菅グループで開発されたRaPIDシステムと呼ばれる特殊な環状ペプチド合成技術により創製された。
