
細胞内を移動するタンパク質「ダイニン」が 動いているときの構造が見えた!
細胞内の物質輸送を行う分子モーターが動く仕組みの解明へ
リリース概要
中央大学理工学部 助教 今井洋(元英国リーズ大学)、大阪大学大学院理学研究科 教授 昆隆英、理化学研究所研究員 島知弘(現東京大学大学院理学系研究科 助教)らの研究グループは、英国国立リーズ大学スタン=バージェス博士、ピーター=ナイト教授と共同で、細胞内で多種多様な物質輸送を行うタンパク質モーター「ダイニン」が駆動しているところを、低温電子顕微鏡法 により直接観察することに成功しました。
本研究をもとに、様々な疾患に関連したダイニンの変異体の可視化が実現すれば、将来、神経疾患や成長異常の原因の解明や治療などへの展開が期待されます。また、癌の原因の解明や治療への利用も期待されます。
本研究成果は、英国のオンライン科学雑誌『Nature Communications』(日本時間平成27年9月14日(月)付)に掲載されました。
背景
私たちの体を構成する細胞は、効率的な物質輸送システムを内包しており、核、ミトコンドリア、RNA、タンパク質など多種多様な物質を、必要な場所に必要なタイミングで輸送しています。この輸送システムは、私たちが生きていくうえで欠くことのできない重要なもので、その機能が部分的にでも失われると、脳神経系疾病、発生異常、がん発症などに関連すると考えられています。
細胞内物質輸送システムの中核を担うのは、分子モーターと呼ばれる2種類のタンパク質群―キネシンとダイニンです。細胞の周辺方向(微小管 プラス端方向)への物質輸送を主に駆動するキネシンについては、その運動のしくみを原子レベルで議論することが可能な段階にまで研究が進展しています。対照的に、細胞の中心方向(微小管マイナス端方向)への物質輸送を一手に担う『ダイニン』については、半世紀にわたる精力的な研究にもかかわらず、その動くしくみはいまだに良くわかっていません。
ダイニン研究の進展を阻んできた主要因のひとつは、その構造情報が十分ではないことにありました。ここ数年で、ダイニン中核領域(モータードメイン)の原子構造は、X線結晶構造解析法 により明らかにされてきました。しかし、ダイニンの動くしくみを理解する上で最も重要な、『ダイニンが微小管上を直進運動する姿』を捉えることは、技術的に極めて難しく、成功例は皆無でした。
研究で得られた知見
本研究では、低温電子顕微鏡法 により、微小管の上を動いている最中のダイニンの構造をとらえることに、初めて成功しました。本研究は、この研究のために特別にデザインした組換えダイニンを用い (図1) 、約6年間をかけて低温電子顕微鏡観察条件の最適化を行い、新規画像解析法を適用した結果、達成されたものです。
本研究により得られた重要知見は次のとおりです。
1.ダイニンが微小管上を運動する際にとる、2つの主要な新規構造を発見しました。 (図2)
2.ダイニンは2本の脚(モーター領域)を用いて微小管上を直進運動しますが、上記のそれぞれの新規構造において、2本の脚がどの方向を向き、相対的にどのような距離にあり、微小管に対してどのような角度で結合するかという、運動機構理解の根幹となる構造情報が得られました。 (図3)
3.ダイニンは微小管に結合した状態で最大20nm 以上も揺らぎながら直進運動することが明らかになりました。 (図3)
上記「1」の2つの主要な構造が同じ割合で存在していたことから、ダイニンはこの2つの構造を交互にとって運動していると考えられます (図4) 。この運動様式は、これまでに集中的に研究が行われてきたほかの分子モーター(キネシンやミオシン)のものとは大きく異なり、ダイニンは全く新しいしくみで細胞内物質輸送を駆動していることが明らかになりました。さらに本研究は、低温電子顕微鏡法を活用することで、世界で初めて微小管上の輸送に関わる分子モーターの運動中の構造を直接可視化することに成功したもので、技術的にも大きな革新と言えます。
研究の波及効果
ダイニンは、神経細胞の成長因子やmRNA、アルツハイマー病の原因と考えられているアミロイドβタンパク質 の前駆体を輸送することが知られていて、ダイニンの変異や機能の異常は様々なヒトの神経疾患や成長異常と関連すると考えられています。本研究をもとに、神経変性疾患などの原因となる異常なダイニンの運動中の様子も可視化できる可能性が開けました。その可視化が実現されれば、将来は、神経疾患や成長異常の原因の解明や治療などに展開することが期待されます。また、ダイニンは細胞分裂時に、チェックポイントのコントロールを行うことも知られています。そのため、細胞分裂の異常である癌の原因の解明や治療にも、将来利用できる可能性があります。
参考資料
本研究の内容について、英国リーズ大学が作成した解説ビデオを以下のURLからご覧いただけます。
(日本語字幕あり) https://youtu.be/bt7noctUrac
研究資金
本研究は、以下の研究資金によって得られたものです。
科学技術振興機構戦略的創造研究推進事業、文部科学省科学研究費助成事業(26291034)、Human Frontiers Science Program (HFSP) Program Grant (RGP0009/2008-C)、Biotechnology and Biological Sciences Research Council (英国) (BB/BB/K000705/1)。
文献情報
<タイトル>“Direct observation shows superposition and large scale flexibility within cytoplasmic dynein motors moving along microtubules”
日本語訳:細胞内の物質輸送を行う分子モーター「ダイニン」が動いているときの構造及び揺らぎの直接観察
<著者>Hiroshi Imai, Tomohiro Shima, Kazuo Sutoh, Matthew L. Walker, Peter J. Knight, Takahide Kon & Stan A. Burgess
<掲載誌>Nature Communications, Published online 14th September 2015
参考図

図1 細胞内に存在しているダイニンと本研究のために遺伝子組み換え技術により作成したダイニンの模式図
ダイニンは、1本の長いポリペプチドからできていて、3次元構造は主に3つの部位から構成されている。(1)細胞内の化学的なエネルギーであるATPを加水分解する直径約13nmのリング、(2)そこから伸びる長さ約10nmで太さが2nmの細長いストークと呼ばれる構造(その先端は微小管結合部位)、そして、(3)2つのリングをつなぎ合わせる尾部の2つの構造から成る。モーター領域は、尾部を除く、リングとストークの部位である。

図2 微小管上を歩いている2量体のダイニンを瞬間的に凍結した後に、冷凍状態のまま観察した電顕写真。
中央左右に長く横たわっているのが、微小管で、その周りにダイニンが結合していることがわかる。2つのリングが見える構造と2つのリングが上下に重なってあたかも1つのリングのように見える構造の2種類の構造が観察された。微小管の極性は左側がプラス端で、右側がマイナス端である。
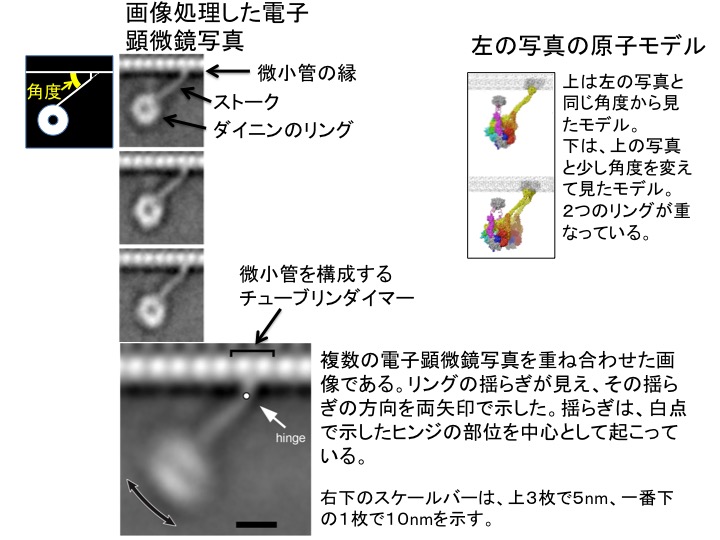
図3 画像処理した電子顕微鏡写真(左の縦に4枚の画像)と原子モデル(右)。
左:微小管上で動作しているダイニンは、2つのリングが重なっている構造を取る。上の3枚の電顕写真は多数の画像を分類した後に、平均化して得られた平均画像。下の1枚の電顕写真は、それらをさらに重ね合わせた画像。ストークはマイナス端方向を指して微小管に結合しているが、それぞれの結合角度は異なる。ここでいう結合角度とは、左上の模式図で、黄色で示した角度のことである。ダイニンは微小管結合部位の極近傍にヒンジ(蝶番のような部位)を持ち、そのヒンジから先が大きく(最大で20nm)揺らぎながら動作することが初めて明らかとなった。右:左の写真の原子モデル。2つのリングが左では1つに見えるが、実は2つのリングが重なっていることを示している。
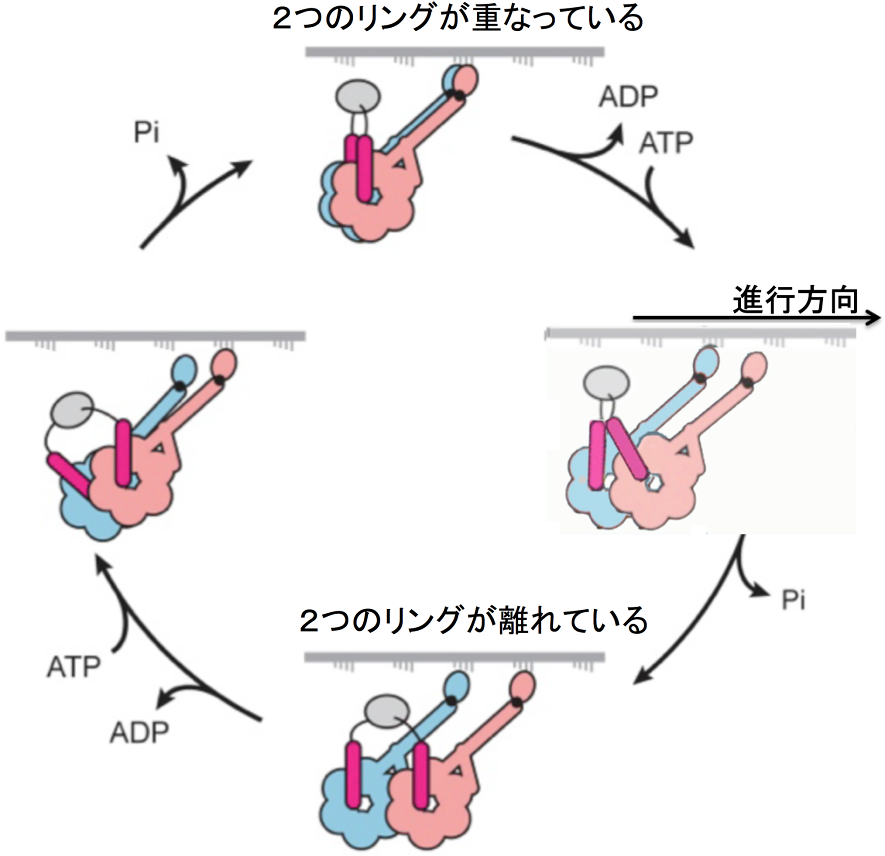
図4 本研究結果から予想されるダイニンの歩行メカニズム。
2つのリングが重なっている構造と2つのリングが離れている構造が1対1で存在していたので、それらの構造を交互にとっていると解釈できる。この図の上下の2つの構造がそれに対応する。中央の2つの構造はこれまでの研究から予想される上下の2つの構造をつなぐ中間体の構造である。この図の1番上で示したような横並びの構造を歩行中の分子モーターが取るということは、他の分子モーターも含めて本研究が初めての報告である。
参考URL
用語説明
- 低温電子顕微鏡法
タンパク質を溶液中で瞬間的に凍結して、そのまま冷凍状態で観察する手法です。電子顕微鏡内部は真空状態で、電子線を出して試料を観察します。室温では真空のためタンパク質の周りの水が蒸発し、タンパク質が変性してしまいます。そこで、マイナス約180度の液体窒素でタンパク質試料を瞬間的に凍結して、凍結していますが水分を含んだ生の状態に近い条件で観察します。
- 微小管
チューブリンと呼ばれるタンパク質が重合してできている中空の直径約25nmで長さは数マイクロメートル(1マイクロメートルは、1ミリメートルの1,000分の1の長さ)の繊維状の細胞骨格です。チューブリンは単量体としては溶液中に存在せずに、常にチューブリンダイマーとして2量体で存在することが知られています。また、微小管には極性があり、重合の早い方をプラス端、重合の遅い方がマイナス端と呼ばれています。一般に、細胞の核周辺に微小管のマイナス端があり、細胞膜近くにプラス端があります。この微小管に沿って多種多様な物質が分子モーターを使って輸送されていることが知られています。
- X線結晶構造解析法
高純度かつ高濃度に精製したタンパク質を用意して、温度や湿度をコントロールすると、タンパク質の結晶を作ることができます。その結晶に、X線を当てると、タンパク質の構造に特有な像を生じます。この像は複雑な斑点からなるパターンですが、その斑点の位置から計算によりタンパク質に含まれる原子の位置を詳細に決めることができます。これがX線結晶構造解析法です。
- nm
ナノメートル:
1nmは、1ミリメートルの100万分の1の長さです。
- アミロイドβタンパク質
アルツハイマー病を発症すると脳内で、アミロイドβタンパク質が蓄積していることが古くから知られています。この蓄積が進むと神経細胞が正常に活動できなくなっていき、最後にはその神経細胞が死んでしまいます。そのため、アミロイドβタンパク質がアルツハイマー病の原因であると考えられています。アミロイドβタンパク質は、その前駆体のタンパク質が、細胞内で切断を受けて生成することが知られています。
