インフルエンザ脳症の発症メカニズムを解明
ウイルス蛋白の蓄積阻害により、予防・治療できる可能性
研究成果のポイント
概要
大阪大学大学院医学系研究科感染症・免疫学講座 ウイルス学の木村志保子特任助教(常勤)、上田啓次教授らの研究グループは、これまで未解明であった、インフルエンザ脳症の発症のメカニズムを解明しました。インフルエンザウイルスが脳血管内皮細胞へ直接感染すること、そして感染の結果産生されたウイルス蛋白の蓄積がインフルエンザ脳症の発症の原因になることを明らかにしました。
インフルエンザ脳症患者さんの脳では ウイルスがほとんど検出されなかったため、インフルエンザ脳症は、ウイルスの直接感染ではなくサイトカインなど感染される宿主側の要因によると考えられてきました。しかし今回、インフルエンザ脳症のモデル動物を新たに確立し解析を進めたところ、脳のウイルス感染自体がインフルエンザ関連脳症の原因になることが明らかになりました。インフルエンザウイルスは、脳に感染しても必ず増殖するわけではありません。しかし、感染すると、ウイルス由来の蛋白が産生されます。このたんぱく質がインフルエンザ脳症の原因となっていました。実際に、亡くなられた脳症患者さんの脳を調べると、動物モデルと同様にウイルス蛋白を検出しました。
研究グループはさらに、このウイルス蛋白の蓄積を抑制することができれば、脳症の発症を抑制し脳浮腫の進行を抑えることができるのではないかと仮定しました。この仮定に基づいてさらに研究を進めたところ、動物モデルにおいて、実際に発症を抑制できることがわかりました。
本研究成果は、英国科学誌「Acta Neuropathologica」(オンライン)に、4月30日(火)(日本時間)に公開されました。
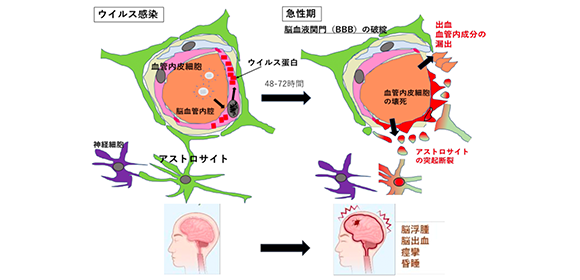
図1. インフルエンザ関連脳症発症機序;ウイルスが血管内皮細胞に 感染してウイルス蛋白を産生することにより細胞と血液脳関門の 破綻が起こり、脳浮腫を惹起する。
研究の背景
日本を含む東アジアに多いインフルエンザ脳症のうち、高度脳浮腫を呈し予後の悪い重症型では、ウイルス感染から早い症例で10時間以内に痙攣等の神経学的所見を認め、24時間以内に高度脳浮腫で死亡、または重度の後遺症を残します。“インフルエンザ”という名前がついていますが、SARS-COV2を含む他の病原体でも発症し、また近年は小児のみならず広い年齢層からの報告が相次いでいます。現時点ではこの疾患に対する根治療法は存在しません。ウイルス感染により高度脳浮腫を呈するという病態でありながら、患者さんの脳からはウイルスがほとんど検出されず、炎症も認めないことが、この疾患における大きな疑問点でした。感染される宿主側要因に関する研究は進んでいましたが、ウイルス感染から脳浮腫を呈するまでのわずか数日間のウイルスの動きや脳浮腫の発症因子を探る、というウイルス側からのアプローチは、そのあまりにも早い臨床経過ゆえに困難でした。
今回研究グループは、ウイルス投与により脳症を発症する脳症モデル動物を確立しました。そしてこの脳症モデル動物を利用することによって、ウイルス感染後から高度脳浮腫に至るまでのウイルスの動き、それに関与する細胞、病態を探りました。
研究の内容
まず、ウイルス投与法や投与量を工夫して、インフルエンザウイルス投与後72時間までに脳浮腫を発症するモデル動物を確立しました。あわせて、この脳浮腫を発症するモデル動物がヒトにおけるインフルエンザ関連脳症と同様の病理学的、臨床的特徴を備えているかどうかの確認を、ヒトの脳の所見と比較しながら検証しました。
次に、確立したモデル動物でウイルス動態を調べました。その結果、ウイルス投与後早期からウイルス蛋白が脳血管内皮細胞やアストロサイトに存在することがわかりました。このことから、脳に存在し時間とともに増加しているのは、大量のウイルス蛋白であり、生きたウイルス粒子はわずかに存在するも脳では増殖していないことがわかりました。
さらに、このウイルス蛋白の蓄積を抑制することができれば、脳症の発症を抑制し脳浮腫の進行を抑えることができるのではないかと仮定しました。仮定に基づいて研究を進めると、これらのウイルス蛋白は、mRNAの転写もしくは蛋白翻訳を抑制する薬剤によって産生が抑制されること、またウイルス蛋白の産生を抑制することにより、脳症モデル動物の症状を抑えることができることが判明しました。
また、同じウイルス感染症でも、どこに、そしてどの細胞に感染するかにより、効果のある薬剤が異なってくることが判明しました。今回のインフルエンザ関連脳症のモデル動物にはインフルエンザウイルスを感染させていますが、通常のインフルエンザウイルス感染症では効果がある一部の既存の抗ウイルス薬が、このモデル動物には効果がありませんでした。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、現時点では根治療法の存在しないインフルエンザ関連脳症を予防・治療できる可能性が出てきました。早期にウイルス蛋白の産生を阻害することで救命、もしくは神経系後遺症を低減することができるかもしれません。また、同様の方法を用いることで、インフルエンザウイルス以外の急性脳症への治療法開発が進むことも期待されます。
特記事項
本研究成果は、2024年4月30日(火)(日本時間)に英国科学誌「Acta Neuropathologica」(オンライン)に掲載されました。
タイトル:“Viral entry and translation in brain endothelia provoke influenza-associated encephalopathy”
著者名:Shihoko Kimura-Ohba1,2,4*, Mieko Kitamura2, Yusuke Tsukamoto2, Shigetoyo Kogaki4, Shinsuke Sakai3, Hiroaki Fushimi5, Keiko Matsuoka5,6, Makoto Takeuchi6, Kyoko Itoh7, Keiji Ueda1 and Tomonori Kimura3(*責任著者)
所属:
1. 大阪大学 大学院医学系研究科 感染症・免疫学講座 ウイルス学
2. 医薬基盤・健康・栄養研究所
3. 大阪大学 大学院医学系研究科 腎臓内科学
4. 大阪急性期総合医療センター 小児科・新生児科
5. 大阪急性期総合医療センター 病理科
6. 大阪母子医療センター 病理科
7. 京都府立医科大学大学院医学研究科 分子病態病理学
DOI:https://doi.org/10.1007/s00401-024-02723-z
本研究は、JSPS若手研究(21K15638)、JSPS特別研究員RPD(18J40004)、日本医療研究開発機構(AMED)ウイルス当感染症対策技術開発事業(20he0822008j0001)、老化メカニズムの鶏鳴・制御プロジェクト(1gm5010001)の一環として行われました。
参考URL
用語説明
- インフルエンザ脳症
インフルエンザウイルス感染に伴って発症し、意識障害・痙攣など神経症状を呈する急性の経過をたどる病気。東アジアの小児に多く報告されてきたが、近年は高齢者を含む年齢層・地域からの報告も増加している。また、インフルエンザウイルスに限らず、SARS-COV2、突発性発疹の原因であるヘルペスウイルス6型など、他の病原体による症例も多数報告されている。
- 血管内皮細胞
心臓から毛細血管までのすべての血管内腔に存在する扁平で薄い細胞。血管内腔を循環する血液と直接接し、血球成分や種々の生理活性物質を産生・分泌し、生体反応を調節する役割を担う。
- 脳浮腫
脳実質内に内出血や正常値以上の水といった異常な水分が貯留し、脳容積が増大した状態。
- 血液脳関門
血液と脳を含む中枢神経系の組織液との間の物質交換を制限する機構。ただし、脳下垂体など、関門が存在しない部位もある。血液脳関門は脳の微小血管に局在し、血管内皮細胞を含む3種類の細胞と基底膜で構成され、通過させる物質を厳しく選択している。
- サイトカイン
主に免疫系細胞から分泌され、細胞間の情報伝達を担うタンパク質。
- アストロサイト
脳を含む中枢神経系に存在するグリア細胞のひとつ。血液脳関門を構成する細胞のひとつでもあり血流や神経伝達など中枢神経系で重要な役割を果たしている。
